3-Арилметилидзамещенные 5-R-3Н-фуран-2-оны, являются чрезвычайно интересными в химическом отношении соединениями, они и их производные обладают широким спектром биологической активности. С целью синтеза новых потенциально физиологически активных веществ актуальна структурная модификация их производных. Строение 5-R-3-арилметилиден-3Н-фуран-2-онов предполагает возможность введения их в реакции с различными бинуклеофильными реагентами. Нами исследована реакция 3-арилметилиден-3Н-фуран-2-онов с бинуклеофилом ‒ тиомочевиной.
Ранее нами установлено, что взаимодействие 5-фенил-3-арилметилиден-3Н-фуран-2-онов с тиомочевинной приводит к образованию 2-амино-6-арил-5-(2-оксо-2-фенилэтил)-5,6,-дигидро-4Н-1,3-тиазин-4-онов [1].
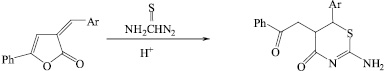
С целью осуществления альтернативных направлений реакции, получения азотсодержащих гетероциклов, нами были изменены условия ее проведения.
Взаимодействие 5-фенил-3-арилметилиден-3Н-фуран-2-онов 1а-с с тиомочевинной при соотношении реагентов 1:1,5 при нагревании в течение 5 часов в изопропиловом спирте с каталитическими количествами MeONa привело к выделению продукта, который по данным элементного анализа и спектральным характеристикам соответствует образованию 5-(2-оксо-2-фенилэтил)-6-арил-2-тиоксотетрогидропиримидин-4(1Н)-онов (2а-с).
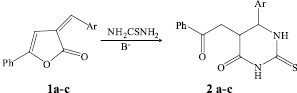
1а, 2а Ar = Ph; 1b, 2b Ar = 4-MeO-С6Н4; 1с, 2с Ar = 2-Cl-С6Н4.
Соединения 2а-с выделены с выходом до 76 %.
В ИК-спектре соединений 2а-с отмечены полосы поглощения карбонильных групп в области 1703-1701 см–1, «Амид I» в области 1653-1641 см–1, «Амид II» в области 1568-1558 см–1, две узкие полосы вторичных аминогрупп в области 3376-3299 см–1, колебания ароматических колец в области 1601-1597 см–1. В ЯМР1H спектре соединения 2а-с отмечены сигналы протонов NH группы в области 1,24-1,56 м.д. и 4,18-4,52 м.д., дублет протона третичного атома углерода при 4,82-5,27 м.д., мультиплет протона третичного атома углерода при 2,95-3,35 м.д., два двойных дублета протонов при вторичного атоме углерода в области 3,25-3,78 м.д. и 1,87-2,90 м.д., серия сигналов ароматических протонов в слабом поле при 6,84-8,01 м.д., синглет протонов метокси-группы при 3,78 для соединения 2b.
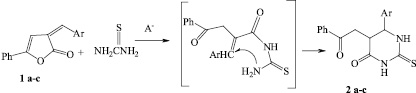
В условиях основного катализа наиболее вероятна первоначальная нуклеофильная атака атома азота аминогруппы тиомочевины по атому углерода карбонильной группы, обладающего наибольшим дефицитом электронной плотности, что приводит к раскрытию лактонного цикла образованием интермедиата, который стабилизируется циклизацией через атом азота второй аминогруппы тиомочевины с образованием устойчивого шестичленного цикла 2а-с.
Таким образом, условия основного катализа при взаимодействии 5-фенил-3-арилметилиден-3Н-фуран-2-онов с тиомочевинной позволяют изменить направление процесса, способствуют образованию 5-(2-оксо-2-фенилэтил)-6-арил-2-тиоксотетрогидропиримидин-4(1Н)-онов.
Экспериментальная часть
ИК – спектры записаны на приборе ИК фурье-спектрометре ФСМ-1201 в таблетках KBr, спектральный диапазон – 400-4000 см–1. Спектры ЯМР1Н получены на спектрометре Varian-400, при 20-25 °С в CDCl3, внутренний стандарт ТМС. Рабочая частота 400 МГц.
5-(2-Оксо-2-фенилэтил)-6-арил-2-тиоксотетрогидропиримидин-4(1Н)-онов (2а-с).
Смесь 0,0012 моль 5-Ph-3-арилметилиден-3Н-пиррол-2-она (1а-с) и 0,0018 моль тиомочевины кипятят в изопропиловом спирте в течение 5 часов, с каталитическим количеством метилата натрия, выливают в холодную воду, нейтрализуют раствором соляной кислоты. Выпавшие кристаллы отфильтровывают, перекристаллизовывают из этилового спирта.
2a: Выход: 73 %, Тпл, °С 169-171 °С. Найдено: С, 66.82; Н, 4.95; N, 9.12; S, 9.63 С18H16N2O2S. Вычислено С, 66.64; Н, 4.97; N, 8.64; S, 9.88. ЯМР1Н (400 MHz, CDCl3): d 3,40; 3,78(д.д, 1H, CH2); 2,77; 2,31(д.д, 1H, CH2); 4,82 (д, 1H, CH); 3,27-3,35 (м, 1Н, СН); 1,56 (с,1H, NH); 4,52 (с,1H, NH); 6,92-7,89 (м, 10, Ar).
2b: Выход: 72 %, Тпл, °С 152-154 °С. Найдено: С, 64.02; Н, 4.78; N, 7.82; S, 9.22 С19H18N2O3S. Вычислено С, 64.39; Н, 5.12; N, 7.90; S, 9.05. ЯМР1Н (400 MHz, CDCl3): d 3,25; 3,67 (д.д, 1H, CH2); 2,55; 1,87(д.д, 1H, CH2); 5,27 (д, 1H, CH); 2,95-3,04 (м, 1Н, СН); 1,24 (с,1H, NH); 4,18 (с,1H, NH); 6,84-8,01 (м, 9, Ar); 3,78 (3Н,с, СН3).
2c: Выход: 76 %, Тпл, °С 160-162 °С. Найдено: С, 59.85; Н, 4.42; N, 8.21; S, 9.07 С18H15ClN2O2S. Вычислено С, 60.26; Н, 4.21; N, 7.81; S, 8.94. ЯМР1Н (400 MHz, CDCl3): d 53,31; 3,39(д.д, 1H, CH2); 2,82; 2,90(д.д, 1H, CH2); 5,13 (д, 1H, CH); 3,12-3,21 (м, 1Н, СН); 1,44 (с,1H, NH); 4,32 (с,1H, NH); 6,96-8,00 (м, 9, Ar).
Работа выполнена при финансовой поддержке РФФИ (Грант 10-03-00640-а) и гранта Президента РФ для государственной поддержки молодых российских ученых №МК-2054.2011.3.
Библиографическая ссылка
Бурухина О.В., Аниськова Т.В., Егорова А.Ю. ВЗАИМОДЕЙСТВИЕ 5-ФЕНИЛ-3-АРИЛМЕТИЛИДЕН-3Н-ФУРАН-2-ОНОВ С ТИОМОЧЕВИННОЙ В ОСНОВНОЙ СРЕДЕ // Современные наукоемкие технологии. 2012. № 10. С. 73-75;URL: https://top-technologies.ru/ru/article/view?id=31009 (дата обращения: 30.01.2026).



