Целью данной работы является моделирование обратимого электродного процесса при ЛМП на ПЭ для ОЭП и простых электродных реакций для любых значений параметра Н=(zFl2w,)/(RТD), а так же максимальное упрощение расчётов полных вольтамперных кривых при заданном значении равновесного потенциала.
При постановке краевой задачи учитывали основные особенности изучаемого процесса: обратимость электродного процесса, ограниченность области диффузии и форму изменения потенциала. Решение краевой задачи получено в явном виде относительно тока на электрод. Выражение для тока имеет вид:
![]() (1)
(1)
где S - площадь электрода, n - число электронов; F - постоянная Фарадея, Кл/моль; R - газовая постоянная, Дж/К·моль,
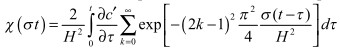 ,
,
безразмерная функция тока,
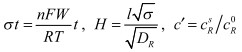 -
-
нормированная концентрация металла на электроде, которую находим согласно [4].
Уравнение тока для катодного процесса с учетом соотношения ![]() и знака изменения потенциала получим
и знака изменения потенциала получим ![]() .
.
C помощью функции Дирака можно показать, что при H → 0 :
![]() (2)
(2)
Важным свойством дельта функции согласно [7], является равенство:
![]() (3)
(3)
Для плоского электрода справедливо:
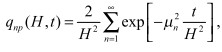 (4)
(4)
где ![]() Очевидно, что при H → 0 qnp (H, t) = 0, при t ≠ 0 . Также
Очевидно, что при H → 0 qnp (H, t) = 0, при t ≠ 0 . Также
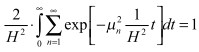 (5)
(5)
То есть, qnp (H, t) при H → 0 является дельтаобразной последовательностью по определению. Воспользуемся свойством свёртки (4). Тогда:
![]() (6)
(6)
Для проверки правильности соотношения (6) и области её применения проведёно сравнение вольтамперных кривых, рассчитанных по формуле (1) и (6) в интервале Н от 1 до 0,01.
Результаты расчётов по уравнению (6) показали, что с уменьшением параметра Н величина ошибки быстро уменьшаются и при Н = 0.1 становится менее 1%.
Нами впервые предложен параметр Н в качестве критерия подобия для плоских тонкоплёночных электродов и ОЭП, характеризующий массообмен на границе раздела фаз между электродом и раствором электролита. Величина Н показывает соотношение скорости электрохимической реакции, определяемой скоростью изменения потенциала, и диффузии, обусловленной взаимодействием между молекулами в растворах (металлических, жидких), пропорциональное квадрату толщины плёнки электрода (анодный процесс) или электролита (катодный процесс).
Выразив коэффициент диффузии в формуле для параметра Н через коэффициент вязкости, выше приведённые соотношения можно применять не только для амальгамных электродов, но и для электродов с образованием твёрдых растворов.
Литература.
- Sevcik A //Collection Czechoslov. Chem. Communs. 1949. V.13. P.349.
- Randles J.E.// Trans. Faraday Sos. 1948. V.44. P.327.
- De Vries W.T., Van DalenE//Electroanalitical Chemistry. 1967. V.14. P.315.
- Назаров Б.Ф., Стромберг А Г. // Электрохимия. 2005. T.41, №1. С. 49-68.
- Назаров Б.Ф., Стромберг А.Г., Ларионова Е.В.// Электрохимия. 2005. T.41, №1. С. 69-75.
- Антипенко И.С., Косинцев В.И, Назаров Б.Ф.// Тезисы докладов. IIV Конференция. Аналитика Сибири и Дальнего Востока. Новосибирск 2004. Т.1. С. 87.
- Багров В.Г., Белов В.В., Задорожный В.Н., Трифонов А.Ю.// Методы математической физики. Томск. 2002. Часть 1. С. 466-476.
Библиографическая ссылка
Антипенко И.С., Косинцев В.И, Иванов Ю.А., Назаров Б.Ф., Хустенко Л.А. МОДЕЛИРОВАНИЕ ОБРАТИМОГО ЭЛЕКТРОДНОГО ПРОЦЕССА ПРИ ПРОТЕКАНИИ ПРОСТОЙ ЭЛЕКТРОХИМИЧЕСКОЙ РЕАКЦИИ И ЛИНЕЙНОМ ИЗМЕНЕНИИ ПОТЕНЦИАЛА ЭЛЕКТРОДА В ТОНКОПЛЁНОЧНОЙ СИСТЕМЕ // Современные наукоемкие технологии. 2005. № 11. С. 21-22;URL: https://top-technologies.ru/ru/article/view?id=26404 (дата обращения: 09.03.2026).



