Введение
В современной медицине все больший интерес вызывают вопросы лечения и профилактики заболеваний сердечно-сосудистой системы, возникновение которых в значительной мере связано с нарушением структуры и функций сердечной мышечной ткани (атеросклероз, инфаркт миокарда, гипертензия, астма и др.). В связи с необходимостью более глубокого изучения этиологии и патогенеза заболеваний сердечно-сосудистой системы, познания механизмов, лежащих в основе этих состояний, возрастает интерес к фундаментальным исследованиям структурно-функциональных особенностей сердечной мышечной ткани.
1 Общая характеристика сердечной мышечной ткани
Сердце - основной орган человека, предназначенный для осуществления движения крови в его теле.
Стенка сердца состоит из трех оболочек:
- Внутренняя оболочка - эндокард;
- Средняя, или мышечная, оболочка - миокард;
- Наружная, или серозная, оболочка - эпикард.
В организме человека все мышечные ткани, в том числе и сердечная мышечная ткань, специализированы на функции сокращения и развиваются на общей основе: гипертрофии и видоизменении сократимой механической актин-миозиновой системы.
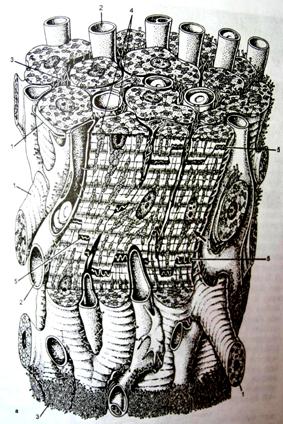
Сердечная мышечная ткань относится к поперечнополосатой мышечной ткани целомического типа, встречается только в мышечной оболочке сердца (миокарде) и устьях связанных с ним крупных сосудов; образована структурными элементами (клетками, волокнами), которые имеют поперечную исчерченность вследствие особого упорядоченного взаиморасположения в них актиновых и миозиновых миофиламентов и обладает спонтанными (непроизвольными) ритмическими сокращениями (рис. 1).
Основным функциональным свойством сердечной мышечной ткани является способность к спонтанным ритмическим сокращениям, на активность которых влияют гормоны и нервная система (симпатическая и парасимпатическая).
Для понимания структурно-функциональных особенностей сердечной мышечной ткани рассмотрим процессы ее формирования в период развития сердца и кардиомиогенеза.
2 Развитие сердца и кардиомиогенез
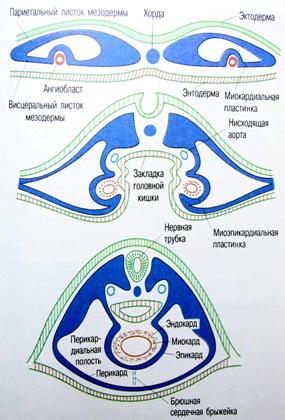
Закладка сердца человека происходит в начале 3-й недели развития (у эмбриона длиной 1,5 мм) и представлена парным скоплением мезенхимных клеток в задней части головного отдела эмбрионального щитка под висцеральным листком мезодермы (рис. 2, 3). С течением времени эти скопления превращаются в две удлиненные трубки, вдающиеся вместе с висцеральным листком мезодермы в целомическую полость тела, и выстилаются эндотелием. Позднее мезенхимные трубки сливаются и из их стенок образуется эндокард.
|
|
|
|
Рис.
1. Строение
сердечной мышечной ткани |
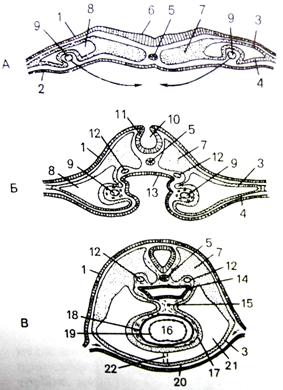
Рис. 2. Стадии (I - III) развития сердца человека
|
|
|
Рис. 3. Развитие сердца человека
А - две парные закладки сердца; Б - их
сближение; В - слияние в одну непарную закладку; 1 - эктодерма; 2 -
энтодерма; |
Перикард формируется из париетального листка мезодермы.
Широкое пространство между эндотелиальными трубочками и миокардиальной пластинкой заполняется эндокардиальным гелем.
По мнению А.Г. Кнорре слой образующегося эпикарда (его мезотелиальное покрытие) нарастает на зачаток миокарда позднее, со стороны венозного синуса. Поэтому первичную закладку сердца предлагается называть не миоэпикардиальной пластинкой, а миокардиальной.
Источником развития сердечной мышцы служит утолщенный участок висцерального листка спланхнотомов - миокардиальная пластинка, формированию которой предшествует миграция презумптивных клеток сердца - кардиомиобластов. Способность к миграции определяется субстратом, по которому передвигаются клетки.
На стадии 4-12 сомитов в развивающемся сердце человека в кардиомиоцитах появляются миофибриллы. Позже образуются апикальные комплексы, развивающиеся во вставочные диски. К началу 4-й недели эмбриогенеза начинаются синхронизированные сокращения мышечных клеток, при этом электрическая связь осуществляется через клеточные соединения - нексусы.
Клетки зачатка миокарда (миокардиальная пластинка), т.е. кардиомиобласты, производят процесс деления и на 2-м месяце эмбрионального развития в них появляются миофибриллы с поперечной исчерченностью. Z-полоски появляются одновременно с саркотубулярной сетью и поперечными инвагинациями клеточной мембраны (Т-системы). На плазмолеммах контактирующих миобластов образуются десмосомы. Формирующиеся миофибриллы прикрепляются к плазмолеммам, где позднее образуются вставочные диски.
В конце 2-го месяца начинает формироваться проводящая система сердца, завершение образования всех отделов которой завершается к 4-му месяцу. Развитие мышечной ткани левого желудочка происходит быстрее, чем правого.
Первые нервные терминали выявляются в предсердиях на 5,5 недели развития эмбриона, а на 8 недели обнаруживаются ганглии, состоящие из 4-10 нейробластов. Из клеток ганглиозной пластинки образуются холинергические нейроны, глиоциты и мелкие гранулярные клетки. Врастание нервных волокон в развивающемся сердце человека идет поэтапно. Сначала появляются нервные волокна в правом, затем в левом предсердиях, позже - в правом, затем в левом желудочке. При этом в предсердиях выявляются веточки от симпатических стволов, а позднее - ветви грудных симпатических волокон.
Опорный скелет сердца образован фиброзными кольцами между предсердиями и желудочками и плотной соединительной тканью в устьях крупных сосудов. Кроме плотных пучков коллагеновых волокон, в состав опорного скелета сердца входят эластические волокна, а иногда встречаются хрящевые пластинки.
В процессе развития сердце человека увеличивается в объеме в 16 раз в сравнении с сердцем новорожденного, при этом в 15 раз возрастает объем кардиомиоцитов.
Таким образом, рост миокарда происходит из-за полиплоидизации ядер кардиомиоцитов и гипертрофии, которая свойственна внутриклеточной регенерации, т.е. умножением числа внутриклеточных структур и увеличением массы гиалоплазмы. Полиплоидизация и гипертрофия обеспечивают увеличение миокарда при его развитии, а также осуществляют компенсационный рост ответ на повышенную нагрузку на сердце, когда может происходить небольшой всплеск митотической активности, но часто без цитотомии.
В процессе развития сердечной мышечной ткани происходит инверсия митотического индекса: на ранних этапах развития максимальная пролиферативная активность наблюдается в желудочках, а позднее более интенсивно митозируют миоциты предсердий.
Итак, кардиомиоциты представляют собой некамбиальную, медленно растущую популяцию, не имеющую сателлитов.
2.1 Строение внутренней оболочки сердца эндокарда
Эндокард выстилает изнутри камеры сердца, папиллярные мышцы, сухожильные нити и клапаны сердца. Толщина эндокарда в различных участках неодинакова: толще в левых камерах сердца, особенно на межжелудочковой перегородке и в устье крупных артериальных стволов - аорты и легочной артерии, а на сухожильных нитях значительно тоньше. По строению она соответствует стенке сосуда.
Поверхность эндокарда, обращенная в полость сердца, выстлана эндотелием, состоящим из полигональных клеток, лежащих на толстой базальной мембране. За ним следует подэндотелиальный слой, образованный соединительной тканью, богатой малодифференцируемыми соединительнотканными клетками. Ниже располагается мышечно-эластический слой, в котором эластические волокна переплетаются с гладкими мышечными клетками. Эластические волокна сильнее выражены в эндокарде предсердий, чем в желудочках. Гладкие мышечные клетки больше всего развиты в эндокарде у места выхода аорты и могут иметь многоотростчатую форму. Самый глубокий слой эндокарда - наружный соединительнотканный слой, который находится на границе с миокардом и состоит из соединительной ткани, содержащей толстые эластические, коллагеновые и ретикулярные волокна.
Питание эндокарда производится в основном диффузно из-за наличия крови, находящейся в сердечных камерах. Кровеносные сосуды имеются только в наружном соединительнотканном слое эндокарда.
2.1.1 Клапаны сердца
Клапаны сердца - предсердно-желудочковые и желудочково-сосудистые - развиваются из эндокарда, а также из соединительной ткани мио- и эпикарда. Клапаны располагаются между предсердиями и желудочками сердца, а также желудочками и крупными сосудами.
Левый предсердно-желудочковый клапан появляется в виде эндокардиального валика, в который к 2,5 месяцам врастает соединительная ткань из эпикарда. На 4-м месяце из эпикарда в створку клапана врастает пучок коллагеновых волокон, образующий позже фиброзную пластинку. Правый предсердно-желудочковый клапан закладывается как мышечно-эндокардиальный валик. С 3-го месяца эмбриогенеза мышечная ткань правого атриовентрикулярного клапана уступает место соединительной ткани, врастающей со стороны миокарда и эпикарда. У взрослого человека мышечная ткань сохраняется в виде рудимента только с предсердной стороны в основании клапана. Таким образом, предсердно-желудочковые клапаны являются производными как эндокарда, так и соединительной ткани миокарда и эпикарда.
Предсердно-желудочковый (атриовентрикулярный) клапан в левой половине сердца двустворчатый, в правой трехстворчатый и представляют покрытые эндотелием тонкие фиброзные пластинки из плотной волокнистой соединительной ткани с небольшим количеством клеток. Эндотелиальные клетки, покрывающие клапан, частично перекрывают друг друга в виде черепицы или образуют пальцевидные вдавливания цитоплазмы. Кровеносных сосудов створки клапанов не имеют. В подэндотелиальном слое выявлены тонкие коллагеновые волокна, постепенно переходящие в фиброзную пластинку створки клапана, а в месте прикрепления дву- и трехстворчаточого клапанов - в фиброзные кольца. В основном веществе створок клапанов обнаружено большое количество гликозаминогликанов.
На границе между восходящей частью дуги аорты и левым желудочком сердца локализуются аортальные клапаны, которые по своему строению имеют много общего с предсердно-желудочковыми клапанами и клапанами легочной артерии.
Аортальные клапаны имеют двойное происхождение: синусная сторона образуется из соединительной ткани фиброзного кольца, покрываемая эндотелием, а желудочковая - из эндокарда.
2.2 Строение средней оболочки сердца миокарда
Мышечная оболочка сердца - миокард (myocardium) - состоит из тесно связанных между собой поперечнополосатых мышечных клеток - сердечных миоцитов или кардиомиоцитов, которые составляют только 30-40% общего числа клеток сердца, но образуют 70-90% его массы. Между мышечными элементами миокарда располагаются прослойки рыхлой соединительной ткани, сосуды и нервы.
Различают два типа кардиомиоцитов:
- Типичные, или сократительные (рабочие) сердечные миоциты (myociti cardiaci)желудочков и предсердий;
- Атипичные, или проводящие сердечные миоциты (myociti conducens cardiacus) проводящей системы сердца.
2.2.1 Сердечные миоциты желудочков и предсердий
Рабочие кардиомиоциты желудочков (рис. 4) содержат сплошную массу миофиламентов, отдельные единицы которых отчетливо не выявляются. Миофиламенты располагаются гексагонально так, что каждая толстая нить окружена шестью тонкими. В линиях Z гексагональное расположение миофиламентов заменяется на тетрагональное. Тонкие линии не сразу переходят в линии Z. Между актиновыми филаментами и Z-нитями располагаются «аксиальные» (осевые) нити длиной, соответствующей молекуле тропомиозина, поэтому предполагают, что аксиальные структуры линии Z главным образом содержат тропомиозин, и, кроме того, в Z-полосках найдены α-актинин, десмин, виментин и филамин. Возможно, что соединительные Z-нити замыкаются сами на себя или связывают аксиальные нити соседних саркомеров. Линии Z оплетаются промежуточными филаментами, проходящими в межфибриллярном пространстве и скрепляющими группы миофиламентов между собой. На уровне Z-полосок обнаружены лептомерные структуры (зебрательца, или костомеры), находящиеся с внутренней стороны сарколеммы. Они располагаются перпендикулярно по отношению к миофибриллам. Вместе с Т-каналами цистерны саркоплазматического ретикулума образуют преимущественно диады. Мембраны ретикулума содержат в своем составе Ca2+-активируемую транспортную аденозинтрифосфатазу (АТРазу), обеспечивающую накопление ионов Ca2+ внутри цистерн саркоплазматического ретикулума. При релаксации миофиламентов ионы Ca2+ всасываются в ретикулум, достигая по его каналам терминальных цистерн.
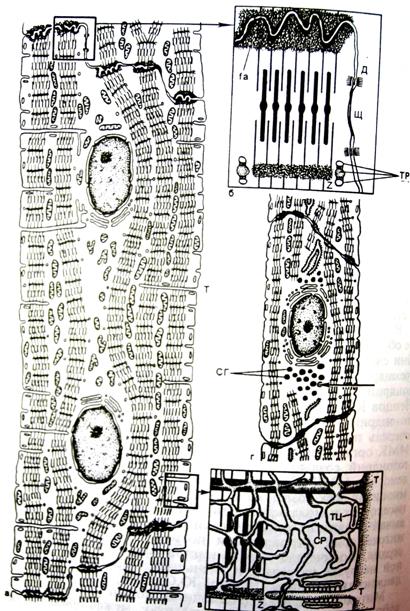
Рис. 4. Строение кардиомиоцита сердца.
а - фрагмент желудочковогомиоцита с малым увеличением, б, в - участки с большим увеличением, г - кардиомиоцит предсердия с секреторными гранулами (СГ), Д - десмосомы, Щ - щелевые соединения (нексусы), fa - промежуточные контакты связи саркомеров соседних клеток, Т - каналы Т-системы, СР - саркоплазматический ретикулум, Z - полоска Z, ТЦ - терминальные цистерны, ТР - триады
В цитоплазме кардиомиоцитов большое количество митохондрий, не образующих ветвящихся текстур и связанных между собой специализированными межмитохондриальными контактами, образуя единый функциональный комплекс. Подобные многочисленные контакты объединяют митохондрии в небольшие группы - кластеры, способные соединяться между собой. Тем самым межмитохондриальными контакты организуют в общую цепь потенциалы одиночных митохондрий, создавая единую энергетическую систему. Выделяется важность биологической роли подобных контактов, характерных для митохондрий интенсивно и постоянно работающих клеток сердца. Количество этих контактов возрастает при повышенной нагрузке на орган и уменьшается при ограничении подвижности организма человека.
Митохондрии в кардиомиоцитах можно разделить на три субпопуляции - субсарколеммальную, межфибриллярную и околоядерную. В субсарколеммальной субполяции митохондрий большая часть их неправильно-округлой формы и образует небольшие скопления под сарколеммой, названные «почками». Эти скопления располагаются в местах наибольшего сближения кардиомиоцита с капиллярами. Большая часть митохондрий межфибриллярной зоны клеток имеет цилиндрическую или овальную форму. Они ориентированы вдоль продольной оси клетки и располагаются между миофибриллами. Третья субпопуляция митохондрий, околоядерная, находится у полюсов ядер и образует скопления.
Сарколемма кардиомиоцита включает в себя базальную мембрану (гликокаликс толщиной 20-60 нм) и плазмолемму. Со стороны цитоплазмы к сарколемме присоединяются тонкие филаменты цитоскелета, а с внешней стороны - коллагеновые и эластические волокна и ряд других внеклеточных белков.
Т-каналы желудочковых миоцитов имеют характер глубоких поперечных складок на уровне линий Z, их продольных ветвей и анастомозов вблизи дисков А. Объем Т-системы в желудочковых миоцитах составляет 27-36% от объема цитоплазмы. По каналам данной системы у кардиомиоцитов не только распространяется импульс, но и поступают метаболиты в клетку.
Специализированными структурами кардиомиоцитов являются «вставочные диски», которые представляют собой комплекс, состоящий из промежуточных соединений (fascia adherens), нексусов (щелевые контакты) и десмосом (рис. 5, 6). Вставочные диски всегда находятся на уровне линий Z и содержат плотный материал, в котором много липидов и ряд белков, в том числе α-актинин, виментин, винкулин, десмин, спектрин, коннектин и др.
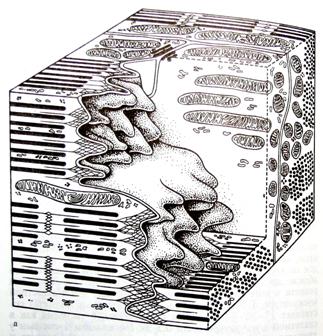
Рис. 5. «Вставочные диски» кардиомиоцитов
Объемная модель фрагментов двух кардиомиоцитов на уровне вставочного диска. Видны пальцевидные выросты клеток, которые на срезе имитируют рисунок «вставочного диска»
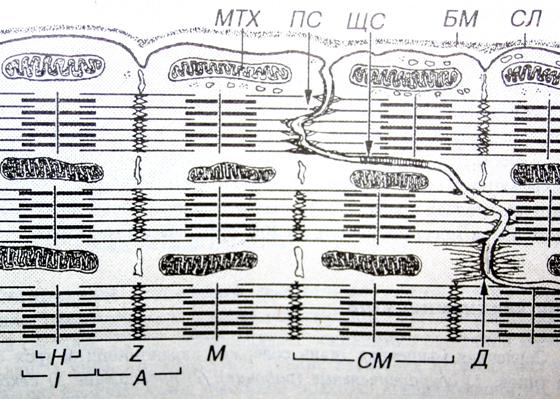
Рис. 6. Ультраструктурная организация области «вставочного диска» кардиомиоцитов
В поперечных участках «вставочного диска» соседние кардиомиоциты образуют многочисленные интердигитации, связанные контактами типа десмосом (Д). Актиновые филаменты прикрепляются к поперечным участкам сарколеммы вставочного диска в участке полоски слипания (ПС). На сарколемме продольных участков «вставочного диска» располагаются щелевые соединения (ЩС). БМ - базальная мембрана, СЛ - сарколемма, МТХ - митохондрия. СМ - компоненты саркомеры.
Клеточные соединения в виде десмосом имеют характерное строение, а нексусы в основном располагаются вдоль продольной оси клетки. В этих образованиях сближаются мембраны контактирующих клеток, образуя многочисленные коннексоны, при этом через гидрофильный канал распространяется нервный импульс и происходит обмен метаболитами между соседними миоцитами. Промежуточные соединения, или полоски слипания, представляют собой уплотненные участки плазмоллем контактирующих клеток и связывают конечные саркомеры соседних миоцитов. Вставочные диски соединяют друг с другом продольно лежащие миоциты с образованием тяжей или функциональных волокон. Часто плотные вставочные диски имеют ступенчатый вид.
Рабочие миоциты предсердий в отличие от желудочковых содержат секреторные гранулы и имеют способность к митозу. Данные миоциты мельче желудочковых и часто с отростками. Миофибриллярных элементов в них меньше на 40%, и реже наблюдаются лестничные структуры во вставочных дисках. Гранулярный эндоплазматический ретикулум и аппарат (комплекс) Гольджи развиты в этих клетках сильнее, чем в желудочковых миоцитах. Характерно, что Т-система в рабочих миоцитах предсердий почти не развита и если присутствуют, то каналы располагаются вдоль, а не перпендикулярно продольной оси клетки.
В предсердных миоцитах содержится пептидный гормон, состоящий из аминокислотных остатков и называемый кардиодилатином. Производное указанного гормона - циркулирующий в крови пептид (атриопептин, кардионатрин, или предсердный натрийуретический пептид) вызывает сокращение гладких мышечных клеток артериол, увеличивает почечный кровоток и ускоряет клубочковую фильтрацию и выделение Na, регулирует уровень артериального давления. Секреторные гранулы расположены главным образом в миоцитах передней стенки правого предсердия и в ушках сердца. Возможно, что в предсердных миоцитах также синтезируются ренин, регулирующий тонус сосудов сердца, и ангиотензиноген.
Энергия, необходимая для сокращения сердечной мышцы, образуется в основном из-за взаимодействия АДФ с креатинфосфатом, в результате чего образуются креатин и фосфат. Главным субстратом дыхания в сердечной мышце являются жирные кислоты и в меньшей степени - углеводы. Процессы анаэробного расщепления углеводов (гликолиз) в миокарде (кроме проводящей системы) сердца существенного значения не имеют.
2.2.2 Сердечные миоциты проводящей системы сердца
Миоциты проводящей системы сердца (рис. 7). К проводящей системе сердца (systema conducens cardiacum) относятся мышечные клетки, формирующие и проводящие импульсы к сократительным клеткам сердца. В состав проводящей системы входят синусно-предсердный и предсердно-желудочковый узлы, предсердно-желудочковый пучок (пучок Гиса), его ножки и концевые разветвления ножек, образованные клетками Пуркинье. В сердце человека клетки проводящей системы сильно отличаются по размерам и структуре от рабочих миоцитов. Различают три типа мышечных клеток, которые в разных соотношениях находятся в соответствующих отделах данной системы.
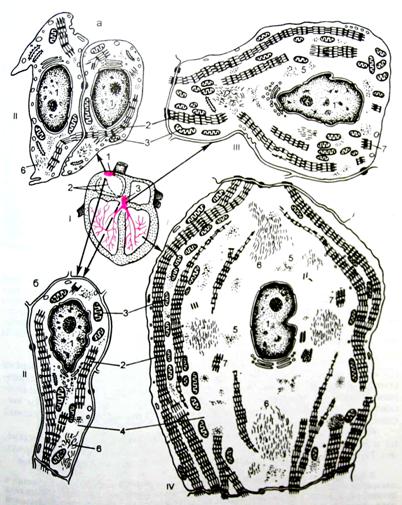
Рис. 7. Кардиомиоциты проводящей системы сердца
I - схема расположения элементов проводящей системы сердца; II - кардиомиоциты синусного и атриовентрикулярного узлов: а - Р-клетки, б - переходные клетки; III - кардиомиоцит из пучка Гиса (волокна Пуркинье): 1 - ядра; 2 - миофибриллы; 3 - митохондрии; 4 - саркоплазма; 5 - глыбки гликогена; 6 - промежуточные филаменты; 7 - миофиламентные комплексы.
Синусно-предсердный (синусный) узел содержит водители ритма, или пейсмекерные (ведущие) клетки (pacemaker cells - Р-клетки), занимающие центральную часть узла и способные к самопроизвольным сокращениям. Данные клетки располагаются гранулами, бедны миофибриллами и митохондриями, почти лишены предсердных гранул и имеют светлую цитоплазму. Упаковка миофиламентов в составе миофибрилл рыхлая, при этом миофибриллы могут ветвиться и изгибаться. Линии Z имеют неправильную конфигурацию. Пейсмекерным клеткам свойственна медленная диастологическая деполяризация. Данные клетки генерируют потенциал движения и при этом в проводящей системе преобладает анаэробный гликолиз, а в саркоплазме много гликогена.
Другим типом клеток синусного узла, находящегося по его периферии, является переходный, или латентный тип. В таких клетках больше миофибрилл и нексусов, а в некоторых из них есть Т-каналы. Данные клетки проводят импульс из синусного узла к другим клеткам предсердия, а именно от Р-клеток к клеткам предсердно-желудочкового пучка и рабочему миокарду.
Предсердно-желудочковый узел имеет клетки, схожие с миоцитами синусного узла. Оба узла сильно иннервированы с преобладание адренергических терминалей. Каждый миоцит имеет и афферентную, и эфферентную иннервации.
Предсердно-желудочковый пучок (пучок Гиса) представляет прямое продолжение предсердно-желудочкового узла и покрыт «чехлом» из плотной соединительной ткани. Ножки пучка разветвляются под эндокардом, а также по толщине миокарда желудочков и проникают в сосочковые мышцы.
Клетки пучка Гиса, названные клетками Пуркинье, неявно отличаются от рабочих миоцитов желудочков. Клетки Пуркинье - самые крупные клетки не только в проводящей системе, но и во всем миокарде, поэтому они крупнее рабочих миоцитов, а миофибриллы в них тонкие, малочисленные и расположены в основном по периферии клеток. В их цитоплазме много гликогена в виде агрегатов с белками - гликосом, содержащих десмогликоген, который резистентен к кислотам, щелочам, амилазе и нерастворим в воде. В клетках Пуркинье много промежуточных филаментов, при этом почти полностью отсутствуют Т-каналы. Клетки Пуркинье в совокупности образуют предсердно-желудочковый ствол и ножки пучка, концевые разветвления которого называются волокнами Пуркинье.
В проводящей системе сердца преобладают энзимы, принимающие участие в анаэробном гликолизе (фосфорилаза, дегидрогеназа молочной кислоты). В проводящих волокнах уровень калия ниже, а кальция и натрия выше в сравнении с сократительными кардиомиоцитами.
2.3 Строение наружной оболочки сердца эпикарда и перикарда
Наружная оболочка сердца, или эпикард (epicardium), представляет висцеральный листок перикарда (pericardium). Эпикард образован тонкой пластинкой соединительной ткани, плотно срастающейся с миокардом. Свободная поверхность ее покрыта мезотелием. В основе эпикарда различают поверхностный слой коллагеновых волокон, слой эластических волокон, глубокий слой коллагеновых волокон и глубокий коллагеново-эластический слой, составляющей до 50% всей толщины эпикарда.
В перикарде соединительнотканная основа развита сильнее, чем в эпикарде. Здесь много эластических волокон, особенно в глубоком его слое. Поверхность перикарда, обращенная к перикардиальной полости, также покрыта мезотелием. Эпикард и париетальный листок перикарда имеют многочисленные нервные окончания в основном свободного типа.
3. Васкуляризация сердца
Сосуды - ветви коронарных артерий - проходят в прослойках соединительной ткани между пучками кардиомиоцитов, распределяясь на капиллярную сеть, в которой каждому миоциту соответствует не менее одного капилляра.
Венечные (коронарные) артерии имеют плотный эластический каркас, в котором выделяются внутренняя и наружная эластические мембраны. Гладкие мышечные клетки в артериях обнаруживаются в виде продольных пучков во внутренней и наружной оболочках.
В основании клапанов сердца кровеносные сосуды в месте прикрепления створок разветвляются на капилляры, откуда кровь собирается в коронарные вены, впадающие в правое предсердие или венозный синус. В эпикарде и перикарде также находятся сплетения сосудов микроциркуляторного русла. Проводящая система сердца, особенно ее узлы, обильно снабжена кровеносными сосудами.
Кровоснабжение сердечной мышечной ткани чрезвычайно обильно: по уровню кровоснабжения (мл/мин/100г массы) миокард уступает только почке и превышает другие органы, включая головной мозг. В частности, этот показатель для сердечной мышцы в 20 раз выше, чем для скелетной.
Лимфатические сосуды в эпикарде сопровождают кровеносные. В миокарде и эндокарде они проходят самостоятельно и образуют густые сети. Лимфатические капилляры обнаружены также в атриовентрикулярных и аортальных клапанах. Из капилляров лимфа, оттекающая от сердца, направляется в парааортальные и парабронхиальные лимфатические узлы.
4 Иннервация сердца
В стенке сердца обнаруживается несколько нервных сплетений и ганглиев. Наибольшая плотность расположения нервных сплетений наблюдается в стенке правого предсердия и синусно-предсердного узла проводящей системы.
Рецепторные окончания в стенке сердца образованы нейронами ганглиев блуждающих нервов и нейронами спинномозговых узлов, а также ветвлениями дендритов равноотростчатых нейроцитов внутриорганных ганглиев (афферентные нейроны).
Эффекторная часть рефлекторной дуги в стенке сердца представлена расположенными среди кардиомиоцитов и по ходу сосудов органа нервными волокнами, образованными аксонами находящихся в сердечных ганглиях длинноаксонных нейроцитов (эфферентные нейроны), которые получают импульсы по преганглиолярным волокнам из нейронов ядер продолговатого мозга, приходящих сюда в составе блуждающего нерва. Эффекторные адренергические нервные волокна образованы ветвлениями аксонов нейронов ганглиев симпатической нервной цепочки, на которых синапсами заканчиваются преганглионарные волокна - аксоны нейронов симпатических ядер боковых рогов спинного мозга.
Пресинаптический аппарат в кардиомиоцитах синапсов характеризуется тем, что практически не удается выделить в миокардиоцитах локальные постсинаптические структуры, так как эффекторные влияния имеют модулирующий характер.
Электротоническое влияния в миокардиальной ткани распространяются далеко за пределы одной клетки, и как следствие, обнаружение высокого коэффициента передачи между кардиомиоцитами, что обусловлено наличием электрических синапсов (щелевых контактов) между клетками. При этом автоматизм сокращения связан с передачей импульса через указанные контакты.
В миокарде много афферентных и эфферентных нервных волокон. Раздражение нервных волокон, окружающих проводящую систему, а также нервов, подходящих к сердцу, вызывает изменение ритма сердечных сокращений. Это указывает на определяющую роль нервной системы в ритме сердечной деятельности, следовательно, и в передаче импульсов по проводящей системе сердца.
5. Функциональная адаптация сердца
Функциональная адаптация клеток в гистогенезе сердечной мышечной ткани проявляется в гетерохромном развитии мышечных элементов миокарда различных отделов сердца. По морфологическим, гистохимическим, гистоавторадиографическим и биометрическим признакам, а также скорости дифференцировки мышечных клеток миокард желудочков, предсердий и мышечные трабекулы отличаются друг от друга, что находится в связи с особенностями гемодинамики, трофики и функции этих отделов миокарда.
Генетически детерминированные основные параметры процессов дифференциации, пролиферации и интеграции клеток миокарда характеризуются известным диапазоном изменчивости, вследствие чего осуществляется адаптация миокарда к конкретным условиям функционировании на каждом этапе фило- и онтогенеза как в норме, так и под влиянием различных внутренних и внешних условий.
6. Возрастные изменения сердечной деятельности
В течение онтогенеза можно выделить три периода изменения гистоструктуры сердца:
- Период дифференцировки;
- Период стабилизации;
- Период инволюции.
Дифференцировка гистологических элементов сердца, начавшаяся еще в эмбриональном развитии человека, завершается к 16-20 годам. Существенное влияние на процессы дифференцировки кардиомиоцитов и морфогенез желудочков оказывает заращение овального отверстия и артериального притока, что приводит к изменению гемодинамических условий - уменьшению давления и сопротивления в малом круге и увеличения в большом. Одновременно выявляется физиологическая атрофия миокарда правого желудочка и гипертрофия левого желудочка. В ходе дифференцировки сердечные миоциты обогащаются саркоплазмой, в результате чего их ядерно-плазменное соотношение уменьшается, при этом количество миофибрилл прогрессивно увеличивается, а мышечные клетки проводящей системы дифференцируются активнее, чем сократительные. При дифференцировке волокнистой стромы сердца наблюдается постепенное уменьшение количества ретикулярных волокон и замена их зрелыми коллагеновыми волокнами.
В период 20-30 лет при обычной функциональной нагрузке сердце человека находится в стадии относительной стабилизации. В возрасте старше 30-40 лет в миокарде обычно начинается некоторое увеличение его соединительнотканной стромы. При этом в стенке сердца, особенно в эпикарде, появляются адипоциты.
Степень иннервации сердца также изменяется с возрастом. Максимальная плотность внутрисердечных сплетений на единицу площади и высокая активность медиаторов отмечаются в период полового становления человека. После 30-летнего возраста уменьшаются плотность холинергических сплетений и количество медиаторов в них сохраняется на постоянном уровне. Нарушение равновесия в вегетативной иннервации сердца предрасполагает к развитию сложных патологических состояний. В пожилом возрасте уменьшается активность медиаторов в холинергических сплетениях сердца.
При повышенных систематических функциональных нагрузках общее количество клеток не возрастает, но в цитоплазме увеличиваются содержание органелл общего значения и миофибрилл, а также размер клеток (функциональная гипертрофия); соответственно возрастает и степень плоидности ядер кардиомиоцитов.
7. Регенерация сердечной мышечной ткани
Для сердца как органа характерна способность к регенерации путем регенераторной гипертрофии, при которой масса органа восстанавливается, но форма остается нарушенной. Подобное явление наблюдается после перенесенного инфаркта миокарда, когда масса сердца может восстановиться как целое, при этом на месте повреждения образуется соединительнотканный рубец, но орган гипертрофируется, т.е. нарушается форма. Происходит не только увеличение размеров кардиомиоцитов, но и пролиферация в основном в предсердиях и ушках сердца.
Ранее полагали, что дифференцировка кардиомиоцитов является необратимым процессом, связанным с полной потерей этими клетками способности к делению. Но на современном уровне многочисленные данные показывают то, что дифференцированные кардиомиоциты способны к синтезу ДНК и митозу. В исследовательских работах П.П. Румянцева и его учеников показано, что после экспериментального инфаркта миокарда левого желудочка сердца в клеточный цикл возвращается 60-70% предсердных кардиомиоцитов, возрастает число полиплоидных клеток, но это не компенсирует повреждение миокарда.
Установлено, что кардиомиоциты способны к митотическому делению (в том числе и клетки проводящей системы). В миокарде сердца особенно много одноядерных полиплоидных клеток с 16-32-кратным содержанием ДНК, но встречаются и двуядерные кардиомиоциты (13-14%) в основном октоплоидные.
В процессе регенерации сердечной мышечной ткани кардиомиоциты участвуют в процессе гиперплазии и гипертрофии, возрастает их плоидность, но уровень пролиферации клеток соединительной ткани в области повреждения оказывается в 20-40 раз выше. В фибробластах активизируется синтез коллагена, в результате чего репарация происходит путем рубцевания дефекта. Биологическое представление подобной адаптационной реакции соединительной ткани объясняется жизненной важностью сердечного органа, так как задержка с закрытием дефекта может привести к гибели.
Считалось, что у новорожденных, а возможно, и в раннем детском возрасте, когда способные к делению кардиомиоциты еще сохраняются, регенераторные процессы сопровождаются увеличением количества кардиомиоцитов. При этом у взрослых физиологическая регенерация осуществляется в миокарде в основном путем внутриклеточной регенерации, без увеличения количества клеток, т.е. в миокарде взрослого человека отсутствует пролиферация кардиомиоцитов. Но недавно получены данные о том, что в здоровом сердце человека 14 миоцитов из миллиона находится в состоянии митоза, завершающегося цитотомией, т.е. количество клеток не значительно, но увеличивается.
Применение современных методов клеточной биологии в клинических и экспериментальных исследованиях позволило перейти к выяснению клеточных и молекулярных механизмов повреждения и регенерации миокарда. Особенно интересны данные о том, что в перинекротических областях и в функционально перегруженном сердце происходит синтез эмбриональных миоакрдиальных белков и пептидов, а также белков, синтезирующихся во время клеточного цикла. Это подтверждает положение о сходстве механизмов регенерации и нормального онтогенеза.
Выяснилось также и то, что дифференцированные кардиомиоциты в культуре способны к активному митотическому делению, что, возможно, объясняется не полной утратой, а подавлением способности кардиомиоцитов возвращаться в клеточный цикл.
Важной задачей теоретической и практической кардиологии является разработка способов стимуляции восстановления поврежденного миокарда, т.е. индукции миокардиальной регенерации и уменьшения соединительнотканного рубца. Одно из направлений исследований предоставляет возможность переноса регуляторных генов, которые превращают фибробласты рубца в миобласты или трансфекция в кардиомиоциты генов, контролирующих рост новых клеток. Другим направлением является перенос в область повреждения фетальных скелетных и миокардиальных клеток, которые могли бы участвовать в восстановлении сердечной мышцы. Также проводятся эксперименты по трансплантации скелетной мышцы в сердце, показывающие образование в миокарде участков сокращающейся ткани и улучшающие функциональные показатели миокарда. Перспективным может быть лечение с применением факторов роста, оказывающих как прямое, так и косвенное воздействие на поврежденный миокард, например, улучшение ангиогенеза.
8. Патологическая гистология сердечной мышечной ткани
Различные повреждающие воздействия на сердце (прекращение притока артериальной крови, травмы, воспаления и др.) могут вызвать некроз мышечной ткани, т.е. гибель мышечных клеток. Некроз, возникающий при нарушении или прекращении кровотока в артериях вследствие тромбоза, эмболии, длительного спазма или в условиях недостаточного коллатерального кровообращения, более характерен для миокарда. Артериальная сеть поперечнополосатых мышц в большом количестве имеет анастомозирующие сосуды, поэтому в случае полного закрытия артерии ишемии не наблюдается. Дистрофические и некротические изменения в мышцах развиваются только при длительном закрытии крупных артерий.
Для миокарда характерны следующие клинико-морфологические формы некроза: коагуляционный некроз, коагуляционный миоцитолиз, колликвационный некроз. В развитии разных типов некроза участвуют различные биохимические механизмы.
В основе коагуляционного (сухого) некроза находятся процессы денатурации белков с образованием труднорастворимых соединений, которые могут длительное время не подвергаться гидролизу. В сердечной мышце коагуляционный некроз (восковидный, ценкеровский некроз) является наиболее частым видом патологии. Одна из важных причин коагуляционного некроза - потеря сократительной способности кардиомиоцитов из-за ацидоза, возникающего при повреждении мембран мышечных клеток, и нарушения функции кальциевых насосов. Наступает атония сердечной мышцы. При этом возрастает давление интерстициальной ткани, а тромбоз, вызывающий коагуляционный некроз, уменьшает внутримышечное кровообращение, что ведет к развитию ишемии.
Выяснено, что в очаге инфаркта кардиомиоциты погибают путем некроза, а в широкой зоне, окружающей некротический очаг, - из-за апоптоза. Предполагают, что путем блокирования апоптоза кардиомиоцитов в этой зоне можно уменьшить общие размеры очага повреждения сердечной мышцы.
Коагуляционный миоцитолиз (гиперконтрактация, дисковидное расщепление) представлен тем, что в мышечных волокнах появляется резко выраженная поперечная исчерченность, заканчивающаяся распадом мышечного волокна на отдельные диски. Появляющаяся неравномерность поперечных полос являются результатом коагуляции сверхсокращенных саркомеров. Причиной коагуляционного миоцитолиза является повышение содержания катехоламинов (симпатическая стимуляция), при котором в мышечной ткани возрастает содержание ионов Ca2+. Подобное явление гибели миоцитов наблюдается в миокарде краевой зоны инфаркта. Уничтожение макрофагами участков некроза приводит к возникновению альвеолярной структуры кардиомиоцитов.
Колликвационный некроз развивается в результате пропитывания миокарда экссудатом из кровеносных сосудов. При этом в клетках возникает внутриклеточный отек и вакуолизация, что обычно может наблюдаться в периваскулярной и субэндотелиальной областях после инфаркта.
Вследствие воспалительной реакции происходит рассасывание омертвевшей мышечной ткани и последующим замещением рубцом. Вокруг пораженного участка наблюдается жировая дистрофия и липоматоз, а также отложение извести.
При атрофии миокарда тяжи кардиомиоцитов постепенно становятся тоньше. В случае сильной атрофии исчезает поперечная исчерченость, продольная же сохраняется дольше. В местах атрофии может развиться воспалительный процесс, образование межуточной соединительной ткани.
Наиболее типичной приспособительной реакцией миокарда на повышение физической нагрузки является гипертрофия. Гипертрофия сердечной мышцы часто относится к рабочим гипертрофиям, при этом наблюдается утолщение мышечных волокон и кардиомиоцитов, обусловленное увеличением количества саркоплазмы и миофибрилл. Установлено, что в миокарде гипертрофия является реакцией на пролиферативные стимулы и гемодинамическую нагрузку кардиомиоцитов, вышедшие из митотического цикла (исследования гипертрофии миокарда при различных воздействиях: бег, плавание, индивидуальные дозированные физические нагрузки, экспериментальная коарктация аорты и др.)
Процесс гипертрофии включает три основных стадии:
1. Аварийная стадия компенсаторной гиперфункции сердца - характеризуется увеличением интенсивности функционирования структур миокарда;
2. Стадия завершающейся гипертрофии и относительной устойчивости гиперфункции;
3. Стадия прогрессирующего кардиосклероза и постепенного истощения при явлениях нарушения синтеза нуклеиновых кислот и белков.
При ряде заболеваний, не связанных непосредственно с воздействием на миокард: алкогольной интоксикации, панкреатите, перитоните, амилоидозе селезенки и др. - также развиваются значительные изменения в ультраструктуре кардиомиоцитов. Это существенно влияет на организацию миофибрилл, митохондрий, межмитохондриальных контактов и других важных органелл кардиомиоцитов и представляют как деструктивные процессы в клетках, так и компенсаторно-приспособитель-ные, направленные на ликвидацию повреждений и энергетического истощения в условиях патологии.
Заключение
Анализ структурно-функциональных особенностей сердечной мышечной ткани показал, что, несмотря на то, что миокардиальная ткань состоит из отдельных клеток, в функциональном отношении она представляет собой единую систему. Способность сердечной мышечной ткани к регенерации, а также адаптация миокарда к конкретным условиям функционирования позволяют по-новому посмотреть на вопросы лечения и профилактики заболеваний сердечно-сосудистой системы, возникновение которых связано с повреждением структуры сердечной мышечной ткани и, как следствие, дисфункцией сердечной деятельности.
На современном уровне полагают, что в проблеме микроциркуляции заложен целый ряд расстройств сердечно-сосудистой деятельности при различных заболеваниях организма. Данная область получила ускоренное развитие особенно во 2-й половине ХХ века и уже сегодня формирует новые принципы в лечении патологий сердца. Импульсом к этому послужило техническое совершенствование исследований трансорганной микрогемодинамики и разработка методологических подходов к анализу гемато-тканевых взаимодействий в системе микроциркуляции.
Проведение научных исследований в различных направлениях, в том числе и микроциркуляционного русла сердца, совершенствование существующих и развитие новых способов оперативного лечения врожденных и приобретенных пороков сердца, применение современного диагностирующего оборудования и эффективных лекарственных препаратов, а также просвещение общества в направлении здорового образа жизни представляют возможность достижения целей, направленных на обеспечение лечения заболеваний сердечно-сосудистой системы и сохранение здоровья человека.
СПИСОК ЛИТЕРАТУРЫ
1. Быков В.Л. Цитология и общая гистология (функциональная морфология клеток и тканей человека) - Спб.: СОТИС, 2002.
2. Гистология / под ред. Ю.И. Афанасьева, Н.А. Юриной - М.: Медицина, 1999.
3. Куприянов В.В., Караганов Я.Л., Козлов В.И. Микроциркуляторное русло. М.: Медицина, 1975.
4. Морфоадаптация мышц в норме и патологии (Сборник научных работ) / под ред. А.А. Клишова - Саратов, 1975.
5. Мышечные ткани: Учеб. пособие / под ред. Ю.С. Ченцова - М.: Медицина, 2001.
Библиографическая ссылка
Гурин А.М. СТРУКТУРНО-ФУНКЦИОНАЛЬНЫЕ ОСОБЕННОСТИ СЕРДЧЕНОЙ МЫШЕЧНОЙ ТКАНИ ЧЕЛОВЕКА // Современные наукоемкие технологии. 2009. № 11. С. 28-40;URL: https://top-technologies.ru/ru/article/view?id=25978 (дата обращения: 17.02.2026).