Взаимодействие I c II и с III носит общий характер реакции Рабе и приводит к образованию продуктов VIII, IX и X, XI.
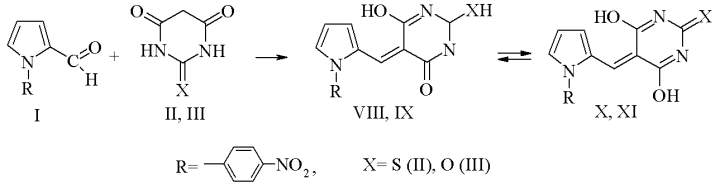
Реакция протекает легко в абсолютном этаноле при добавлении каталитических количеств этилендиаммоний диацетата с выходом VIII - XI от 74 до 84%.
Структуры VIII - XI подтверждены ИК и ЯМР1Н спектрами. В спектре ЯМР1Н продукта VIII имеется уширенный синглет в области 9,87 м. д., принадлежащий сигналам протонов ОН, а возможно и SH групп. В ЯМР1Н спектре соединения IX уширенный синглет в области 10,97 м. д. относится к протонам ОН групп. Очевидно, полученные соединения находятся в равновесии таутомерных форм VIII ↔ X и IX ↔XI.
Реакция I с IV в растворителе (пиридин : пиперидин = 1 : 1) приводит к соединению XII с выходом 70%.
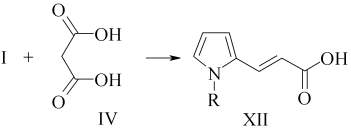
В ЯМР1Н спектре XII имеется сигнал гидроксильных протонов в этиленовом фрагменте с константой спин-спинового взаимодействия 15,6 Гц, что говорит о транс-конформации XII [1].
Реакция конденсации I с V протекает по типу реакции Кневенагеля с образованием XIII (выход 68%).
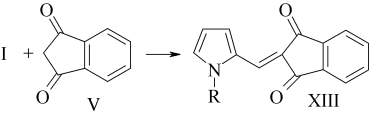
Эта реакция протекает легко в среде абсолютного метанола при добавлении каталитических количеств этилендиаммоний диацетата.
В ИК спектре XIII имеются ν (С=О) as 1673 см-1, ν (С=О) s 1714 см-1 β-дикарбонильного фрагмента.
В ЯМР1Н спектре имеется синглет протона у атома углерода этиленового фрагмента при 7,79 м. д., что подтверждает структуру XIII [1].
Конденсация I с VI проводилась в среде абсолютного метанола в присутствии каталитических количеств СН3ОNa с образованием XIV (38%).
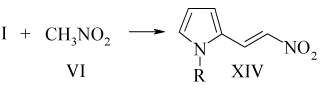
Структура доказана ИК и ЯМР1Н спектрами.
Взаимодействие I с VII требует применения более жестких катализаторов и высокой температуры.
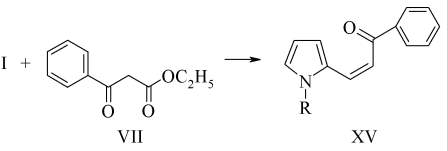
Реакция проведена в метаноле в присутствии эквимольного количества КОН. В данных условиях наблюдается гидролиз сложноэфирной группы с последующим декарбоксилированием, что приводит к образованию XV с выходом 32%.
В ЯМР1Н спектре XV выделены синглеты протонов этиленового фрагмента с константой спин-спинового взаимодействия 7.7 Гц, что указывает на цис-конфигурацию соединения XV [1].
Легкость протекания реакций связана с константами кислотности СН-компоненты и увеличивается в ряду:
VII < VI < V < IV < III < II.
СПИСОК ЛИТЕРАТУРЫ:
- Нейланд О. Я. Строение и таутомерные превращения β-дикарбонильных соединений - Рига: Знание, 1977. - 448с.
Библиографическая ссылка
Пушкарева К.С., Рамазанова Д.Н., Музыченко Г.Ф., Сибирякова М.А., Бурлака С.Д. СИНТЕТИЧЕСКИЕ ВОЗМОЖНОСТИ ПИРРОЛАЛЕЙ В РЕАКЦИЯХ С СН-КИСЛОТАМИ // Современные наукоемкие технологии. 2007. № 12. С. 19-21;URL: https://top-technologies.ru/ru/article/view?id=25794 (дата обращения: 22.12.2025).



