C!7H35COONa + НОН ↔ C17H35COOH + NaOH
Мыла - широко распространенные и давно известные моющие средства - были получены на Ближнем Востоке более 5000 лет назад. Однако они имеют ряд недостатков. Прежде всего, в «жесткой» воде (воде, содержащей растворимые кальциевые и магниевые соли) происходит потеря их моющей способности вследствие образования нерастворимых кальциевых и магниевых мыл.
2C!7H35COO- + Са2+ → (C!7H35COO)2Сa↓
2C!7H35COO- + Mg2+ → (C!7H35COO)2Mg↓
Кроме того, мыла нельзя использовать в качестве моющих средств в кислой среде, так как происходит их разложение с выделением жирных кислот. Моющие свойства мыл значительно снижаются в воде, содержащей большое количество солей, например, в морской. К этим техническим недостаткам обычных мыл следует добавить огромный экономический недостаток - использование для их производства пищевых жиров, колоссальное потребление пищевого сырья в мыловаренной промышленности. Между тем они с успехом могут быть заменены продуктами переработки нефти, угля и природных газов. В настоящее время использование пищевых жиров для получения моющих средств сводится к минимуму. Актуальная задача получения синтетических моющих веществ из непищевого сырья успешно решена. Получен богатый ассортимент синтетических моющих средств СМС, обладающих значительно более высокими моющими свойствами по сравнению с обычными мылами. Особенно широкое распространение эти средства получили в последние десятилетия. Синтетические моющие средства легко дозируются, хорошо растворяются в воде при комнатной температуре, не требуют предварительного умягчения воды и хорошо отмывают загрязнение в воде любой жесткости, в том числе и морской, проявляют моющее действие при сравнительно низкой температуре (20-30° С), хорошо отмывают ткань в нейтральной, кислой и щелочной среде. Основная цель применения МС - удаление загрязнений, которые представляют собой смесь твердых частиц (пыли, сажи, соли и др.) и жировых, белковых пленок, прилипших к поверхности тканей и других предметов. Чтобы удалить загрязнение нужно отделить его от очищаемой поверхности, перевести грязевые частицы в моющий раствор, удержать их в моющем растворе до его смены и устранить возможность повторного осаждения на очищаемую поверхность. Следовательно, моющая жидкость должна обладать хорошей смачивающей способностью, легко проникать в поры тканей и других материалов, в трещины грязевых частиц, а также между загрязнениями и отстирываемой поверхностью. Поэтому основной компонент СМС - поверхностно-активные вещества ПАВ, способные значительно понижать поверхностное натяжение воды.
Поверхностные явления на границе раздела фаз относятся к сложным физико-химическим процессам. Характерной особенностью всех ПАВ является то, что длина их молекулы значительно превосходит ее поперечный размер, их молекулы содержат две части: полярную гидрофильную группу (притягивается к воде) и неполярный гидрофобный (отталкивается от воды) углеводородный или ароматический радикал. Гидрофобной частью, как правило, является углеводородный остаток, содержащий 8-20 углеродных атомов. В его состав могут входить атомы других элементов, а также ароматические и циклопарафиновые кольца. Гидрофильными являются остатки -ОН, -СООН, -NH2, -COONa, -SO3Na и т.п. Полярная группа обладает значительным электрическим моментом диполя и хорошо гидратируется.
При взаимодействии с водой молекулы погружаются в нее своими гидрофильными группами, гидрофобная часть располагается выше уровня воды. Чем длиннее углеводородный радикал, тем хуже вещество растворяется в воде, тем большая доля его находится в поверхностном слое [1]. Уменьшение поверхностного натяжения происходит засчет накопления менее полярных молекул ПАВ в поверхностном слое жидкости и увеличения межмолекулярного расстояния. Взаимное притяжение между углеводородными частями молекул мыла значительно меньше, чем между молекулами воды.
ПАВ по своим физико-химическим свойствам делятся на три группы: молекулярные (электрически нейтральные молекулы спиртов, карбоновых кислот, белков), анион- и катионактивные ионогенные вещества. Молекулы ионогенных ПАВ в водной среде диссоциируют на ионы, однако поверхностно-активным может быть анион или катион.
1. Неионогенные - соединения, не способные к диссоциации в водных растворах
R-X-(-CH2-CH2-O-)n-H
где R - углеводородный радикал, X - сера, кислород или
-NH-CO- , -NH-CH2- , -C6H4-O-
Из неионогенных моющих веществ наиболее распространены вещества, которые получаются взаимодействием эпоксидов с соединениями, содержащими гидроксильную группу (спиртами, фенолами и др.):
![]()
В зависимости от числа молекул эпоксида, участвующих в реакции, получаются вещества с различной длиной молекулы и с различными физико-химическими свойствами. Если, например, олеиловый спирт С18Н37ОН конденсируется с 6-8 молекулами окиси этилена, то получаются вещества, применяемые для мытья шерсти; при конденсации его с 10-15 молекулами - вещества, используемые в качестве моющих средств для искусственного волокна и хлопка; с 20-30 молекулами окиси этилена получаются вещества, применяемые в качестве эмульгаторов.
Неионогенные моющие вещества сохраняют хорошую моющую способность независимо от кислотности и жесткости воды.
2. Ионогенные - соединения, способные к диссоциации в водных растворах.
Ионогенные катионные (катионоактивные). В результате электролитической диссоциации катионактивных веществ часть молекулы, содержащая углеводородный радикал, образует катион и является поверхностноактивной.
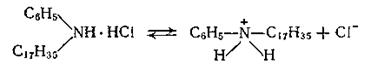
Катионные соединения (органические азотсодержащие основания и их соли) менее эффективны, как моющие средства и применяются в основном в качестве бактерицидных препаратов.
3. Ионогенные анионные (анионоактивные) вещества. В результате электролитической диссоциации анионактивных веществ часть молекулы, содержащая углеводородный радикал, образует анион и является поверхностноактивной.
- алкилкарбонаты - натриевые соли высших карбоновых кислот (от С10 и выше) общей формулы CnH2n+1COONa, т. е. по существу они не отличаются от обычных мыл.
- алкилсульфаты - натриевые соли моносульфоэфиров высших алифатических спиртов CnH2n+1CH 2O-SO 2-ONa
Первичные алкилсульфаты получаются из высших алифатических спиртов нормального строения при действии на них серной или хлорсульфоновой кислот или серного ангидрида:
С13Н27СН2-ОН + Н2SО4 → С13Н27СН2-ОSО2ОН + Н2О
Реакцию ведут непрерывным методом при температуре, зависящей от природы исходных спиртов. Процесс проводят в сульфураторах - аппаратах, изготовленных из кислотоупорной стали и выложенных внутри свинцом, или в эмалированных аппаратах.
Далее полученный сульфоэфир нейтрализуют водным раствором едкого натра при 50-60°С.
С13Н27СН2-ОSО2ОН + NaОН → С13Н27СН2-ОSО2ОNa + Н2О
Исходные высшие алифатические спирты получают восстановлением высших карбоновых кислот нормального строения (которые в свою очередь получаются при окислении парафина).
Вторичные алкилсульфаты R2CH-OSO2ONa получают действием серной кислоты на олефины, содержащиеся в количестве 60-75% в продуктах крекинга парафина [2].
Алкилсульфаты представляют собой твердые кристаллические вещества или желатинообразные осадки. Они обладают очень хорошими моющими свойствами, на которые не оказывают влияния жесткость воды и кислотность среды. Алкилсульфаты практически не гидролизуются. Первичные алкилсульфаты обладают наилучшей моющей способностью при наличии 12-14 углеродных атомов в цепи, вторичные - при наличии 8-18 углеродных атомов.
- алкилсульфонаты - соли жирных сульфокислот общей формулы R-SO 3 -Na, где R - углеводородный радикал, содержащий 12-20 углеродных атомов.
В них атом серы связан непосредственно с атомом углерода, а не через кислород, как у алкилсульфатов. Это дешевые моющие вещества, обладающие достаточной устойчивостью к гидролизу и нечувствительные к жесткости воды. Они получаются действием сернистого ангидрида и хлора (сульфохлорирование) на предельные углеводороды, содержащиеся в керосиновых или масляных фракциях парафинистых нефтей.
СnН2n+1 + SО2 + Сl2 → СnН2n+1SО2Сl + НСl
Полученные сульфохлориды затем переводят в алкилсульфонаты:
СnН2n+1SО2Сl + 2NaOH → СnН2n+1SО3Na + NaCl + H2O
- алкиларилсульфонаты (сульфонолы) - соли алкилированных ароматических сульфокислот, где R - углеводородный радикал, содержащий 12-14 углеродных атомов.
![]()
Алкиларилсульфонаты в связи с простотой их получения, доступностью исходного сырья, хорошей химической стойкостью и моющими свойствами являются наиболее распространенными синтетическими моющими веществами.
Исходными продуктами для их получения служат ароматические углеводороды, в основном бензол. Процесс получения алкилбензолсульфонатов протекает по схеме
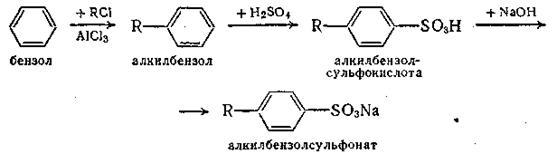
Исходные хлористые алкилы RCl с длинной цепью углеродных атомов, необходимые для синтеза алкилбензолов, получают обычно хлорированием фракций керосиновых дистиллятов, содержащих углеводороды со средним молекулярным весом, соответствующим додекану C12H26 или тридекану C13H28.
Моющее действие обусловлено способностью ПАВ адсорбироваться на поверхностях воды и твердых тел, увеличивать их смачиваемость. Молекулы ПАВ распологаются так, что на поверхности жировых капель будут находиться гидрофильные, а внутри капель - гидрофобные части молекул мыла. Частицы грязи набухают, дробятся, обволакиваются пленкой мыла, при этом уменьшается сцепление частиц грязи между собой и очищаемой поверхностью. При небольшом механическом воздействии (перетирании руками или в стиральной машине) частицы загрязнений легко отделяются и переходят в раствор, где находятся во взвешенном состоянии. Чтобы предотвратить оседание загрязнений на ткань в состав СМС вводят натриевую соль карбоксиметилцеллюлозы [С6Н7О2(ОН)2-ОСН2СООNа]n.
В качестве стабилизаторов пены в СМС добавляются алкилоламиды R-CONHCH2CH2OH в количестве 1-3%.
В зависимости от рН среды моющая способность изменяется. Анионактивные моющие вещества проявляют моющий эффект лишь в щелочной и нейтральной среде, в кислой среде они сами закрепляются на ткани. Катионактивные моющие вещества проявляют моющее действие в нейтральной и слабокислой средах. Поэтому в состав СМС вводят различные добавки. Кислая и нейтральная среды (сульфат натрия Na2SO4) благоприятны для стирки изделий из волокон животного происхождения (шерсть, шелк). Щелочная (сода кальцинированная Na2CO3, тринатрийфосфат Na3PO4, полифосфаты, силикат натрия Na2SiO3) - для стирки изделий из волокон растительного происхождения (лен, хлопок); умеренно щелочная среда - для стирки тканей из искусственных и синтетических волокон. Кроме того, щелочные добавки улучшают эмульгирующую способность и коллоидную структуру моющих растворов, способствуют получению более прочных пленок моющего вещества вокруг частиц загрязнения, смягчают воду, связывают соли жесткости, способствуют разрушению жировых загрязнений.
В некоторые средства для стирки хлопка и льна вводят химические отбеливатели, в большинстве случаев перборат натрия NaВО3. При температуре выше 65°С это соединение выделяет кислород, который обесцвечивает и окисляет органические соединения, одновременно дезинфицируя изделие. Используют также оптические отбеливатели, оседающие на ткани при стирке, но не разрушающие ее.
Некоторые загрязнения белкового происхождения отстирываются особенно трудно. Молекулы белка прочно скрепляются с волокнами ткани и удерживают жир, углеводы, механические загрязнения, причем прочность этих связей со временем возрастает. При стирке в горячей воде, глажении горячим утюгом белок свертывается и еще прочнее скрепляется с волокнами. Для удаления загрязнений белкового происхождения существуют особые стиральные средства («био»), содержащие ферменты - вещества биологического происхождения, которые при температуре не выше 40°С разрушают белки (при температуре выше 600С ферменты разрушаются сами). Эти средства предназначены для стирки изделий из льняных, хлопчатобумажных, искусственных и синтетических волокон. Их нельзя применять для стирки шерстяных и шёлковых тканей - вместе с белковыми загрязнениями разлагается сама ткань.
Таким образом, ПАВ, щелочные добавки, химические отбеливатели и ферменты - это основные вещества, разрушающие загрязнения и удаляющие их с ткани, т.е. основные компоненты современных СМС.
В настоящее время ведутся интенсивные работы по созданию синтетических моющих средств, легко разрушающихся при биохимических методах очистки сточных вод.
СПИСОК ЛИТЕРАТУРЫ:
- Болдырев А.И. // Физическая и коллоидная химия. - М.: Высшая школа, 1983. - 408 с.
- Жиряков В.Г. // Органическая химия. - М.: Химия, 1987. - 407 с.
Библиографическая ссылка
Ермолаева В.А. ХИМИЧЕСКАЯ СТРУКТУРА ОСНОВНЫХ КОМПОНЕНТОВ СИНТЕТИЧЕСКИХ МОЮЩИХ СРЕДСТВ // Современные наукоемкие технологии. 2007. № 10. С. 34-38;URL: https://top-technologies.ru/ru/article/view?id=25515 (дата обращения: 01.03.2026).



