Заметим, что к настоящему времени уже разработан ряд методов получения фенолов и их производных, содержащих адамантильный заместитель в ароматическом кольце [1,3,6], а получение О-адамантилированных фенолов изучено недостаточно. Поэтому изыскание новых путей синтеза подобных структур является актуальным.
Перспективным путем синтеза труднодоступных производных адамантана является использование в качестве исходных реагентов напряженных мостиковых [3.3.1]пропелланов. В практическом и научном отношении среди таких пропелланов представляет интерес тетрацикло[3.3.1.1.3,7.0.1,3]декан (1,3-дегидроадамантан, 1,3-ДГА). Наличие неустойчивой пропеллановой связи, соединяющей инвертированные четвертичные углеродные атомы, делает эти соединения чрезвычайно реакционноспособными в реакциях присоединения с разрывом пропеллановой связи.
В качестве исходных реагентов в реакции с 1,3-ДГА нами были использованы одноатомные фенолы: о-, м-, п-крезолы, о-хлорфенол, п-нитрофенол; двухатомные фенолы: пирокатехин, резорцин, гидрохинон.
Взаимодействие фенолов с 1,3-ДГА осуществлялось в осушенном диэтиловом эфире, при мольных соотношениях реагентов, равном 1: (2÷4) в атмосфере сухого, очищенного от кислорода азота:
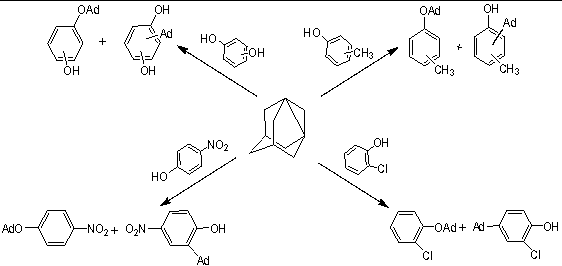
После удаления растворителя, продукты реакции анализировались методом хромато-масс-спектрометрии.
Анализ продуктов реакции показал, что основным направлением реакции является О-алкилирование фенолов 1,3-ДГА с образованием 1-адамантиловых эфиров c выходами 81-95%. Однако при этом всегда, не зависимо от структуры и кислотности фенола, образуются продукты С-адамантилирования в кольцо с выходом 5-19%.
Очистку продуктов реакции осуществляли вакуумной перегонкой или перекристаллизацией. Все полученные эфиры - твердые вещества. Состав и строение полученных соединений подтверждены методами масс-, ИК- и ЯМР 1Н -спектроскопии, элементным анализом. Состав и строение побочных продуктов С-адамантилирования подтверждены масс-спектрометрией и встречным синтезом.
Кроме указанных выше фенолов, содержащих заместители различной природы, представлялось интересным изучение взаимодействия 1,3-ДГА с производными фенола, имеющими наряду с гидроксильной другую функциональную группу, проявляющую еще большие кислотные свойства, например, карбоксильную. В качестве объектов для исследования подобных взаимодействий были выбраны о-, м- и п-салициловые кислоты.
Взаимодействие салициловых кислот с 1,3-ДГА осуществлялось в осушенном диэтиловом эфире, при мольных соотношениях реагентов, равном 1: (2÷4) в атмосфере сухого, очищенного от кислорода азота:
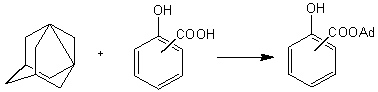
Отметим, что указанные реакции идут исключительно по карбоксильной группе, не затрагивая фенольный гидроксил, что приводит к формированию сложноэфирной связи и получению адамантилсалицилатов с высокими (до 96%) выходами.
Таким образом, разработаны эффективные методы получения адамантилфениловых эфиров и их производных. Реакции протекают в мягких условиях, за непродолжительное время без применения катализаторов и приводят к получению адамантилфениловых эфиров с высокими выходами. Кроме того, установлено, что введение в молекулу фенола дополнительной функциональной группы, проявляющей кислотные свойства, направление реакции идет по пути образования сложных эфиров.
Список литературы
- Мирян Н.И., Юрченко А.Г. Кириенко Е.И. // Укр. хим. журн. 1990. Т. 56. № 2. С. 183.
- Морозов И.С., Петров В.И., Серге-ева С.А. Фармакология адамантанов. - В.: Волгоградская мед.академия. 2001, - 320 с.
- Соколенко В.А., Кузнецова Л.Н., Орловская Н.Ф. // Изв. АН. Серия химическая. 1996. № 2. С. 505.
- Соколенко В.А., Свирская Н.М., Великов А.А., Сизова Н.В. // Кинетика и катализ. 2002. Т. 43. №2. С. 205.
- Сорокина И.В., Крысин А.П., Хлебникова Т.Б., Кобрин В.С., Попова Л.Н. Аналит. обзор. СО РАН; ГПНТБ. Новосиб. Ин-т орган.химии. Новосибирск. 1997.
68 с. (Сер. Экология. Вып. 46.). - Степаков А.В., Молчанов А.П., Костиков Р.Р. Об алкилировании ароматических соединений 1-адамантанолом // ЖОрХ.- 2007.- Т.43.- Вып.4.-с.540-544.
- Хайруллина В.Р., Кирлан С.А. и др. // Изв. АН. Серия химическая. 2006. № 8. С. 1274.
Библиографическая ссылка
Г.М. Бутов, К.Р. Саад, Е.А. Камнева, Н.П. Пастухова 1,3-ДЕГИДРОАДАМАНТАН В РЕАКЦИЯХ С ЗАМЕЩЕННЫМИ ФЕНОЛАМИ // Современные наукоемкие технологии. 2010. № 8. С. 35-38;URL: https://top-technologies.ru/ru/article/view?id=25268 (дата обращения: 13.02.2026).



