В соответствии с действующей технологией отработанный расплав периодически сливают в воду при соотношении расплав : вода = 1 : (2-5), в образующуюся пульпу вводят хлорид бария, серную кислоту, обрабатывают известковым молоком, после чего подвергают фильтрованию. Фильтрат направляют на дополнительную дезактивацию - очистку от радия путем его соосаждения с сульфатом бария, а гидратно-сульфатный кек влажностью 54-56% вывозят в хранилище спецотходов (ХСО) [2-4]. Существующая технология обеспечивает дезактивацию хлоридных растворов СОФ, содержащих, г/дм3: 5 - 15 Th; 10-8 - 10-6 Ra, 10 - 30 Fe(III), 5 - 15 Al, 10 - 30 P3Э, а также хлориды калия, натрия, магния, кальция и др. и имеющих исходную активность до 200 кБк/кг, до установленных норм [5]. Существенным недостатком существующей технологии является образование значительного количества вторичных радиоактивных отходов, подлежащих захоронению в ХСО, что требует больших эксплуатационных расходов и капитальных затрат.
Следует отметить, что проблеме переработки, обезвреживания и дезактивации отходов процесса хлорирования лопаритового концентрата уделяется большое внимание. Разработан целый ряд способов обезвреживания расплава СОФ, направленных на селективное выделение тория, например, электролизом [6], термической возгонкой хлоридов нерадиоактивных металлов из расплава [7]. Подробно изученным и эффективным по степени концентрирования является процесс ионообменного выделения тория из многокомпонентных растворов макропористыми фосфорнокислыми катионитами типа КПФ или аминофосфорнокислыми амфолитами типа АНКФ [8-11]. Указанные варианты технологии переработки расплава СОФ позволяют эффективно концентрировать лишь торий, что касается вопросов очистки растворов от радия, то в цитируемых работах они не рассматривались. Наиболее простыми в аппаратурном оформлении и технологически приемлемыми являются осадительные способы концентрирования тория. Отличаясь невысокой избирательностью, тем не менее, эти способы находят широкое применение в практике переработки радиоактивных отходов. Для повышения степени концентрирования предложена технология [12, 13], основанная на гидролитическом извлечении тория путем предварительного восстановления Fe3+ до Fe2+ стальным скрапом и/или магниевой стружкой и последующего осаждения тория при рН 4,5-5,5 известковым молоком или раствором гидроксида натрия.
Анализ рассмотренных способов позволяет сделать вывод о том, что они направлены на решение одной задачи - повышение степени концентрирования тория в осадке. Что же касается вопроса о дезактивации образующихся растворов, активность которых обусловлена наличием продуктов распада тория, то в каждой из рассмотренных схем предусматривается один и тот же известный прием [14] - соосаждение радия с сульфатом бария путем обработки растворов хлоридом бария, серной кислотой или сульфатом натрия и, затем, известковым молоком. Однако такой прием зачастую не обеспечивает требуемой степени дезактивации, а с другой стороны, приводит к образованию значительных количеств вторичных РАО, подлежащих захоронению в хранилище спецотходов.
В настоящей работе приведены результаты исследований по извлечению радия из технологических растворов с помощью коллектора на основе оксигидрата железа (III). Выбор данного коллектора обусловлен наличием в исходном расплаве СОФ значительного количества FeCl3. Определение удельной активности растворов и содержания радионуклидов радия в пробах проводилось методом гамма - спектроскопии на гамма - спектрометре "Прогресс - гамма (ПДД)", предназначенном для измерения активности радионуклидов в объектах окружающей среды. Активность изотопов Ra-226 и Ra-228 в исследуемых пробах определялась путем обработки полученной спектрограммы на ПЭВМ с помощью программного обеспечения "Прогресс-2000". По активности отдельных радионуклидов определяли их содержание (г/дм3) в исходном и дезактивированном растворах.
В работе использован раствор после выщелачивания расплава СОФ, содержащий, г/дм3: 38,2 РЗЭ; 0,09 Ta; 1,59 Nb; 0,21 Ti; 10,9 Fe; 13,9 Al; 8,2 Th; 265,8 Cl‾; 6,95∙10-7 Ra2+; удельная активность ≈ 92 кБк/кг. Кроме того, для изучения процессов поглощения Ra оксигидратом железа, были использованы радийсодержащие растворы - фильтраты, получаемые путем нейтрализации раствора хлоридов редкоземельных элементов и последующего отделения осадков гидроксидов РЗЭ.
Извлечение тория из растворов вели путем его осаждения в виде гидроксида. Для этого исходный раствор СОФ нейтрализовали до рН 8, 10, 12. Полученную суспензию нагревали до температуры 85±5ºC, выдерживали при этой температуре в течение 20 минут, а затем еще 60 минут без нагревания, после чего фильтровали. В табл. 1 представлены данные о выделении тория нейтрализацией исходного раствора гидроксидом натрия и известковым молоком.
Анализ полученных данных показывает, что масса осадка, а значит, и степень концентрирования тория зависят от вида щелочного реагента - при использовании известкового молока происходит "разбавление" осадка и повышение его массы за счет непрореагировавшей части Са(ОН)2. Поскольку Th (IV) при данных значениях рН практически полностью осаждается, то высокая активность фильтратов обусловлена присутствием радия и продуктов его распада. В результате поглощения радия осадками гидроксидов металлов происходит снижение удельной активности фильтрата, при этом, использование для нейтрализации раствора NaOH приводит к заметному повышению степени дезактивации с ростом рН осаждения, чего не наблюдается в случае использования гидроксида кальция.
Таблица 1. Результаты нейтрализации раствора СОФ
|
№ пробы |
рН |
Выход сухого осадка, кг/м3 |
Влажность осадка, % |
Активность, Бк/кг |
Степень дезактивации, % |
|
1 |
1,15 |
- |
- |
91743,8 |
- |
|
Нейтрализация раствором гидроксида натрия (120 г/дм3) |
|||||
|
2 |
8,00 |
75,97 |
78,91 |
32830,5 |
64,21 |
|
3 |
10,55 |
76,32 |
75,75 |
1135,8 |
98,56 |
|
4 |
12,71 |
73,49 |
71,84 |
322,4 |
99,65 |
|
Нейтрализация известковым молоком (СаО 130 г/дм3) |
|||||
|
5 |
8,23 |
120,14 |
79,40 |
19797,9 |
78,42 |
|
6 |
10,03 |
144,25 |
78,58 |
20020,1 |
78,18 |
|
7 |
12,00 |
195,97 |
77,87 |
20585,7 |
77,56 |
На рис. 1 приведены результаты опытов, характеризующих влияние величины рН на степень поглощения радия оксигидратом железа. Из представленных результатов видно, что тип щелочного реагента по-разному влияет на процесс в зависимости от величины рН.
В результате обработки экспериментальных данных было установлено, что полученным результатам лучшего всего соответствует модель, согласно которой поглощение радия оксигидратом железа протекает как минимум по двум механизмам. В относительно кислых средах (ниже рН изоэлектрической точки), когда поверхность частиц FeOOH заряжена положительно, сорбция радия протекает по катионообменному механизму, сводящемуся к обмену Ra2+ с ионами водорода, входящими в структуру гидроксидного осадка. В условиях отрицательного заряда поверхности, т.е. при рН > рНИЭТ, доминирует ионный обмен во внешней обкладке двойного слоя - обладая более высоким зарядом, ионы Ra2+ встраиваются в адсорбционный и диффузионный слои мицеллы, вытесняя ионы Na+. Обмен между одинаково заряженными ионами Са2+ двойного слоя и ионами Ra2+ раствора затруднен, что объясняет характер зависимости степени поглощения радия от рН при использовании известкового молока.
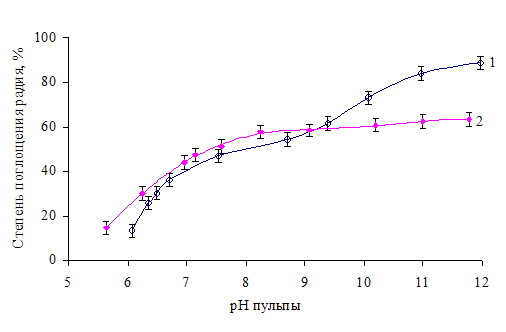
Рис.1. Влияние величины рН на степень поглощения радия оксигидратом железа
Кроме рН на поглощение радия оксигидратом железа оказывают влияние и другие факторы, в частности, концентрация солевого фона. Это влияние связано с десорбирующим действием ионов электролита в случае катионного обмена или обусловлено сжатием диффузионного слоя при вторичной адсорбции.
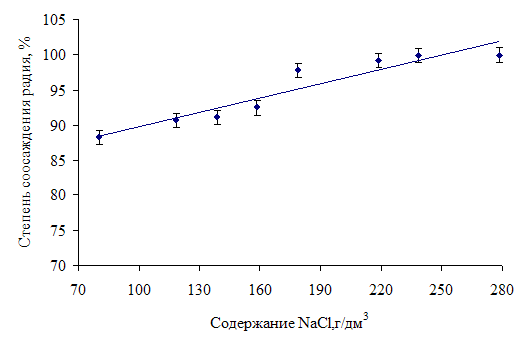
Рис. 2. Влияние концентрации хлорида натрия на степень поглощения радия оксигидратом железа при рН = 12,0±0,2
Характер влияния концентрации хлорида натрия на степень поглощения радия оксигидратом железа при рН = 12,0±0,2 отражен на рис. 2. Из представленных данных видно, что с повышением солевого фона сорбция радия улучшается. Полученное объясняется следующим. В концентрированных растворах оксигидрат железа проявляет специфический вид обменной адсорбции, заключающийся в том, что при образовании адсорбент удерживает часть электролита, который вступает в обменные реакции с ионами микрокомпонента. Сказанное было подтверждено экспериментально - с увеличением концентрации NaCl в исходном растворе повышается количество электролита, удерживаемое осадком оксигидрата железа, о чем свидетельствует увеличение содержания иона Cl‾ в фильтрате после промывки осадка путем репульпации и последующего фильтрования.
При дезактивации технологических растворов с использованием оксигидрата железа большую роль играет температурный режим - при нагревании увеличивается как степень дезактивации, так и производительность фильтрации. Данный эффект объясняется образованием кристаллической формы осадка FeOOH - с ростом рН и температуры старение осадка, понимаемое как кристаллизация и дегидратация свежеосажденного оксигидрата железа, протекает интенсивнее и завершается появлением хорошо идентифицируемых разновидностей: α-FeOOH (гетита), γ- FeOOH (лепидокрокита) и α-Fe2O3 (гематита), причем при рН = 12 и температуре 80 ºС образуется игольчатый микропористый гетит [15], обладающий, по-видимому, наибольшей сорбционной способностью по отношению к радию.
На основании обобщения и анализа совокупности полученных экспериментальных данных по нейтрализации раствора СОФ различными щелочными реагентами, соосаждению радионуклидов, в частности радия, с осадками оксигидрата железа и сорбционным процессам, происходящих в системе радийсодержащий хлоридный раствор - оксигидрат железа разработана принципиальная технологическая схема обезвреживания и дезактивации растворов и/или пульп от гидроразмыва отработанных расплавов СОФ (рис. 3).
Предлагаемая технология предусматривает двухступенчатую дезактивацию растворов, причем на первой ступени при нейтрализации пульп СОФ с исходной активностью 70-90 кБк/кг 2-3М раствором гидроксида натрия до рН 11-12 степень дезактивации достигает 99,0-99,8%, а остаточная активность фильтратов - 200-800 Бк/кг. На второй ступени дезактивации предложено в фильтрат вводить сначала раствор FeCl3 до содержания железа в растворе 5-10 г/дм3, затем раствор NaOH до рН 11-12.
Для реализации данной технологии разработана технологическая установка [16] для переработки, обезвреживания и дезактивации радиоактивных хлоридных растворов от гидроразмыва расплава СОФ.

Рис.3. Технология переработки, обезвреживания и дезактивации радиоактивных хлоридных растворов от гидроразмыва расплава СОФ.
Сопоставительный анализ эффективности существующей и разработанной (рис. 3) технологий показывает, что предлагаемые технологические процессы обеспечивают сокращение массы вторичных радиоактивных отходов, подлежащих захоронению в ХСО в 2-3 раза, что приводит к снижению затрат на эксплуатацию и строительство хранилища. Кроме того, результаты исследований и сравнительных испытаний свидетельствуют о том, что разработанная технология дает возможность существенно снизить удельный расход реагентов на нейтрализацию и дезактивацию и повысить производительность отделения на 40-60%. Все это в совокупности своей обеспечивает [17, 18] улучшение технико-экономических показателей процесса хлорирования лопаритовых концентратов.
СПИСОК ЛИТЕРАТУРЫ:
- Крохин В.А., Соляков С.П., Мальцев Н.А. // Научные труды ГИДЕРМЕТ - М., 1969. Т.34. С. 153-160.
- Кудрявский Ю.П. // Современные наукоемкие технологии. 2005. № 6. С. 12-16.
- Кудрявский Ю.П.//Изв. Академии промышленной экологии. 2005. № 3. С. 52-57.
- Кудрявский Ю.П.//"Наука в решении проблем Верхнекамского промышленного региона". Сб. науч. трудов. Вып.4. Березники: Изд. БФ ПГТУ. 2005. С. 189-196.
- Нормы радиационной безопасности (НРБ-99). М.: Минздрав России, 1999. 116 с.
- Липовка С.Л. Исследование и разработка технологического процесса обезвреживания и утилизации отходов, получаемых при хлорном методе переработки лопаритового концентрата. Автореф. канд. дисс. - М., МИХТ им. Ломоносова. 1982. 24 с.
- Пат. 2169958 РФ. Способ обезвреживания солевых отходов от радиоактивных компонентов / Пойлов В.З., Курмаев Р.Х, Ряпосов Ю.А.и др. - Опубл.: Бюл. №31. 2000. С. 401.
- Кудрявский Ю.П., Белкин А.В. // Радиохимия, 1986. № 4. С. 486-489.
- А.с. 1485606 СССР. Способ извлечения тория из растворов / Кудрявский Ю.П., Белкин А.В., Волков В.В. и др.- Зарег.: 08.02.1989. Опубл.: Бюл.№21. 2000. С. 593.
- Кудрявский Ю.П., Белкин А.В.//Журн. прикладной химии. 1990. Т. 63. С. 946 (Деп. ВИНИТИ 10.10.1989. № 61 83-В89).
- Кудрявский Ю.П., Белкин А.В.// Цветные металлы. 1993. № 12. С. 30-32.
- А.с. № 1185867 ССС). Способ извлечения тория из хлоридных растворов переработки лопаритовых концентратов/ Кудрявский Ю.П., Белкин А.В., Белкин Г.Н. и др. - Зарег.: 15.06.1985. Опубл.: Бюл. № 12. 1999. С. 554.
- Кудрявский Ю.П., Белкин А.В., Василенко Л.В. и др.//Цветные металлы. 1985. № 12. С. 53-56.
- Вдовенко В.М., Дубасов Ю.В. Аналитическая химия радия. Л.: Наука. 1973. 190 с.
- Егоров Ю.В. Статика сорбции микрокомпонентов оксигидратами. М.: Атомиздат. 1975. 200 с.
- Патент РФ на ПМ № 45394. Технологическая установка для дезактивации радиоактивных отходов процесса хлорирования лопаритовых концентратов/Кудрявский Ю.П., Рахимова О.В., Зеленин В.И. и др. Зарег. и опубл. 10.05.2005. Бюл. № 15.
- Кудрявский Ю.П., Черный С.А., Рахимова О.В. //Современные наукоемкие технологии. 2005. № 9. С. 9-11.
- Кудрявский Ю.П., Черный С.А., Рахимова О.В., Зеленин В.И.//Известия Академии промышленной экологии. 2006. № 1. С. 44-50.
Библиографическая ссылка
Кудрявский Ю.П., Рахимова О.В., Черный С.А., Жуланов Н.К. ИЗУЧЕНИЕ ЗАКОНОМЕРНОСТЕЙ СООСАЖДЕНИЯ РАДИЯ С КОЛЛЕКТОРАМИ НА ОСНОВЕ ОКСИГИДРАТА ЖЕЛЕЗА (III) И РАЗРАБОТКА ТЕХНОЛОГИИ ДЕЗАКТИВАЦИИ РАДИОАКТИВНЫХ СОЛЕВЫХ РАСТВОРОВ ПРОЦЕССА ХЛОРИРОВАНИЯ ТИТАНО-НИОБАТОВ РЗЭ // Современные наукоемкие технологии. 2007. № 8. С. 23-28;URL: https://top-technologies.ru/ru/article/view?id=25210 (дата обращения: 04.03.2026).



