1. Диаметр частиц d мал по сравнению с масштабом несущих их пульсационных молей l:
d << l. (1)
При таком предположении каждая частица совершает движение, оставаясь в пределах исходного пульсационного моля. Условию (1) удовлетворяют высокодисперсные частицы: d < 0,5 - 1 мкм.
2. Обтекание частиц турбулентными молями имеет вязкий характер.
3. Гидродинамическое сопротивление частиц движению газообразной среды в соответствии с экспериментально установленной зависимостью при Red < 1 в первом приближении описывается законом Стокса:
Fсопр = 3![]() , (2)
, (2)
где Fсопр - сила сопротивления, η- динамическая вязкость среды , up - скорость обтекания частицы.
Многими экспериментаторами показано, что распределение дисперсных частиц по размеру подчиняется закону Гаусса:
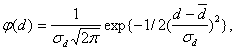 (3)
(3)
где σd - дисперсия распределения, d¯ - средний диаметр частиц. Эти частицы участвуют в необратимых химических реакциях. Для проведения реакций необходимо создать соответствующую температуру. Это можно сделать подогревателем многофазной реакционной смеси. В качестве последнего используется либо электрический обогреватель, либо процесс сжигания метана непосредственно на входе в турбулентный химический реактор.
Рассмотрим следующие химические реакции, протекающие в реакционной зоне реактора. Согласно закону Гесса они протекают по уравнениям:
а). С + О2 ![]() СО2 + 393,5 кДж;
СО2 + 393,5 кДж;
б). С + СО2 ![]() 2 СО - 173 кДж; (4)
2 СО - 173 кДж; (4)
в). 3H2O + 2 C ![]() 3 H2 + CO2 + CO - 353, 4 кДж;
3 H2 + CO2 + CO - 353, 4 кДж;
где K 1,K2, K3 - константы необратимых реакций. Эти реакции необходимы для получения технологических газов: СО2, СО, H2. Основой химических реакций служит зола, получаемая на тепловых электрических централях (ТЭЦ). Для этого необходим реактор в виде стальной трубы с распределенными вводами пара и технического кислорода. Скорость химических реакций (4) определяется следующими зависимостями:
W1 = K1 [ C ][O2];
W2 = K2 [ C ] [CO2]; (5)
W3 = K3 [H2O]3[C]2;
где [C], [O2], [H2O], [CO2] - концентрации углерода, технического кислорода, пара и диоксида углерода. Углерод, молекулярный кислород, пар - являются исходными реагентами, Диоксид углерода получается в результате химических реакций - а), в) формул (4).Размеры химического реактора определяются временем пребывания смеси в реакционной зоне. Необходимо получить турбулентный режим работы реактора. Для этого нужно достаточно малое время пребывания реакционной смеси:
![]() =
= ![]() ; (6)
; (6)
где Vp, V об - реакционный объем и объемная скорость. Объемная скорость рассчитывается через объемный расход и плотность исходной смеси V об = 1,11 • 105 см 3/ сек.. Отсюда следует, что геометрические размеры реактора должны быть следующими: диаметр 10 см и длина 510 см.. Этот аппарат должен быть сделан из титанового сплава ВТ9Л.. Кроме того, на входе реактора должен быть установлен электрический подогреватель. Проволока сделана из медно - никелевого сплава МНМц 43-05. Его мощность рассчитывается по формуле:
Q = U• I; (7)
Тогда мощность подогревателя равна: Q = 29,5 кВт (рис.1). Рассчитаем сопротивление электрического подогревателя:
R1 = ![]() = 22 Ом ; (8)
= 22 Ом ; (8)
где ρ - удельное сопротивление медно - никелевого сплава, l - длина проводника, S - площадь поперечного сечения. Геометрические размеры подогревателя находятся из формулы (8) - l = 157 *10-2 м, S= 28, 26 * 10-6 м2. Поэтому диаметр проволоки должен быть 6 *10-3м. Электрический подогреватель служит для нагрева реакционной смеси до требуемой температуры.
Линейная скорость течения в реакторе равна: Vл = 125 см / сек. Это необходимо для получения турбулентного режима течения:
Re =![]() ; (9)
; (9)
где ν - кинематическая вязкость реакционной смеси. Поэтому: Re = 125000. Константы скоростей химических реакций (5) находятся из справочных данных для температуры 15000С: K1 = 0,87 л/(моль * сек); K2= 0,13 л/(моль * сек); K3 = 0,25 л/(моль * сек). Существование турбулентного режима движения многофазной системы обеспечивает стационарный режим идеального вытеснения (6). В этом случае процесс описывается следующими нелинейными обыкновенными дифференциальными уравнениями:
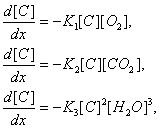
![]() (10)
(10)
![]()
![]() ,
,
![]()
![]() .
.
Эта система дифференциальных уравнений составлена на основе закона действующих масс. Решение системы обыкновенных уравнений с соответствующими начальными условиями (10) приведено на рис. 2 и рис. 3. Расходы технического кислорода, пара и углерода следует из материального баланса:
Vo2 = Vp * W1;
V H2O= Vp * W3; (11)
Vc =Vp * ( W1 + W2 + W3).
Для нахождения концентраций исходных реагентов в потоке воспользуемся уравнениями состояния для турбулентной реакционной смеси:
P1 Vр = (m1 / ρc) RT;
P2 Vр = (m2 /ρO2 ) RT; (12)
P3 Vр =(m3 /ρH2O ) RT;
где P1, P2 , P3 - давления; m1, m2 , m3 - массы; ρc ,ρO2 , ρH2O - плотности углерода, технического кислорода, пара; R - универсальная газовая постоянная, T - температура в реакционной зоне. Поэтому концентрация углерода будет равна - [ C ] = 0,14 м/л. Из справочных данных известно, что концентрации технического кислорода и пара равны - [O2] = 0, 15 м/л , [H2O] = 0,09 м/л. Расходы кислорода , пара и углерода в трубчатом турбулентном реакторе соответственно равны - Vo2 = 0,09 т/ч.;V H2O = 0,02 т/с.; Vc = 6,25 т/ч. . Реактор описывается моделью идеального вытеснения, что справедливо в условиях развитого турбулентного течения многофазной смеси (11 - 12).
Рис. 1. Схема подогревателя из медно-никелевого сплава
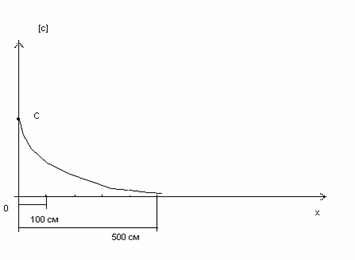
Рис. 2. Распределение концентрации углерода по длине реактора.
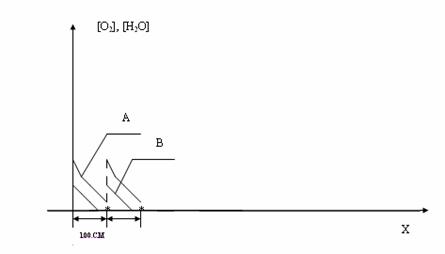
Рис. 3. Распределение концентраций кислорода и пара по длине реактора. А - молекулярный кислород, В - пар
Общее давление в реакторе складывается из давления исходных реагентов и продуктов химических реакций. Согласно технологическим условиям оно равно 2 атм.
Pоб = (P1 + P2 + P3 + Pк.п.); (13)
где Pк.п - давление конечных продуктов. Эти конечные продукты представляют синтез - газ и диоксид углерода (технологические газы) (13).
Примеси в золе представляют вредные вещества для здоровья человека. Поэтому, их необходимо удалять из выбросов предприятия. Удаление можно осуществить в соответствии со следующими реакциями:
1. Pb + O2 → PbO2 ;
2. B + O2 → BO2; (14)
3. Mn + H2O → MnO + H2;
где Pb, B, Mn - свинец, бор, марганец. Эти вещества являются вредными веществами, и они превышают допустимые нормы ПДК. PbO2, BO2, MnO - оксиды вредных веществ, которые имеют более меньшие пределы токсичности (14).
На воздухе свинец покрывается тонким слоем окисла, который медленно превращается в основной карбонат. Жесткая вода создает на свинце такое же покрытие, которое предохраняет воду от загрязнения растворимыми соединениями свинца. Мягкая вода растворяет заметные количества свинца, и это приводит к отравлению воды.
Существует ряд окислов свинца, из которых наибольшее значение имеют окись свинца (свинцовый глет) PbO и двуокись свинца PbO2 .
Свинцовый глет получают при нагревании свинца на воздухе. Это желтый порошок или желтовато - красное кристаллическое вещество, применяемое при производстве свинцового стекла и при получении соединений свинца.
Бор образует блестящие прозрачные кристаллы, обладающие такой же твердостью, как алмаз. Диоксид бора получается в результате необратимой бимолекулярной химической реакции.
Марганец - серебристо-белый металл, обладающий розоватым оттенком. Он активен и замещает водород даже в холодной воде. Основное применение марганец находит при производстве специальных сталей. Марганцовые стали получают из специальных сплавов, содержащих высокий процент марганца и образующихся при восстановлении смеси окислов железа и марганца коксом в доменной печи. Оксид марганца является результатом бимолекулярной химической реакции.
Окисление углерода в реакторе наиболее эффективно протекает в условиях распределенного ввода пара и технического кислорода. Этот процесс и рецикл по технологическим газам позволяет сократить расход подсветочного мазута (876 кг/ч) на современной Череповецкой ТЭЦ.
Библиографическая ссылка
Федоров А.Я., Мелентьева Т.А, Мелентьева М.А. ТЕХНОЛОГИЯ ПЕРЕРАБОТКИ ЗОЛЫ // Современные наукоемкие технологии. 2008. № 4. С. 94-97;URL: https://top-technologies.ru/ru/article/view?id=23767 (дата обращения: 07.03.2026).



