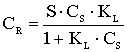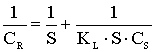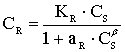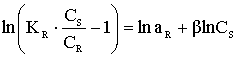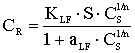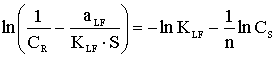Ионообменные катиониты способны избирательно поглощать один сорт ионов по сравнению с другими, что объясняет их широкое применение для разделения смеси ионов. Установление закономерностей ионного обмена является одной из основных задач исследования ионообменного равновесия. Для разделения ионов интерес представляют комплексообразующие карбоксильные катиониты.
Карбоксильный катионит КБ-4Пх2 имеет гелевую структуру и содержит одну фиксированную карбоксильную группу. Близкое расположение карбоксильных групп в структуре катионита объясняет высокую селективность по отношению к поливалентным ионам металлов.
Данная работа посвящена изучению равновесия сорбции ионов бария, меди и иттрия на карбоксильном катионите КБ-4Пх2.
Теоретическая часть
Описание равновесия обмена на комплексообразующих ионитах является частью общей задачи изучения равновесия ионообменных реакций [1]. В общем случае описание равновесия обмена сводится к выводу уравнения изотермы ионообменной реакции и определению константы обмена или коэффициента избирательности. Изотерма ионного обмена характеризует состояние ионообменного равновесия при постоянной температуре. Она связывает между собой количество ионов в каждой из фаз. Изотерма ионного обмена позволяет судить о селективности ионита. Для построения изотермы в статических условиях используют методы переменных концентраций и переменных объемов. Для количественного описания равновесия сорбции могут быть использованы несколько моделей. Некоторые из них приведены в таблице 1.
CR- количество сорбированного иона металла на единицу массы катионита в состоянии равновесия; S - максимальная емкость ионита, ммоль/г, CS - равновесная концентрация ионов в растворе, моль/л, aR ,aLF - константы изотермы Редлиха - Петерсона и Ленгмюра - Фрейндлиха;n - константа изотермы Фрейндлиха, показывающая интенсивность сорбции; B - константа изотермы Редлиха - Петерсона, значение которой должно лежать в интервале ;0<b<1 ,KL , KF, KR и KLF - константы изотермы Ленгмюра, Фрейндлиха, Редлиха - Петерсона и Ленгмюра - Фрейндлиха.
Модель изотермы Ленгмюра основана на том, что на поверхности катионита образуется мономолекулярный сорбционный слой и все активные места обладают равной энергией и энтальпией сорбции [2]. Модель Фрейндлиха используется для описания сорбции на гетерогенной поверхности [2]. В этом случае в первую очередь происходит заполнение активных сорбционных положений с наименьшей энергией, что сопровождается непрерывным изменением энергии сорбции [3]. Особенности моделей Ленгмюра и Фрейндлиха объединены в эмпирические уравнения изотерм Ленгмюра - Фрейндлиха и Редлиха - Петерсона [4].
Таблица 1. Модели изотерм сорбции
|
Модель |
Уравнение |
Номер уравнения |
|
Ленгмюр |
|
(1)
(2) |
|
Фрейндлих |
|
(3)
(4) |
|
Редлих - Петерсон |
|
(5)
(6) |
|
Ленгмюр - Фрейндлих |
|
(7)
(8) |
Эксперимент
Для исследования использовали карбоксильный катионит КБ-4пх2 в водородной и аммонийной формах.
Исходные растворы готовили растворением нитратов меди, бария в дистиллированной воде. Раствор нитрата иттрия готовили растворением оксида иттрия в водном растворе азотной кислоты. Концентрацию металлов определяли комплексонометрическим титрованием [5]. Растворы с меньшей концентрациями меди, бария и иттрия готовили разбавлением исходных.
Изучение зависимости сорбции ионов металлов от концентрации металла проводили по следующей методике: катионит КБ-4Пх2 в количестве 1 г (в пересчете на абсолютно сухую смолу) загружали в полиэтиленовый стакан с 50 мл раствора соли металла определенной концентрации и кислотности. Стакан закрывался крышкой и помещался в термостат до установления равновесия (на 7 суток). Затем сорбент отфильтровывали и в фильтрате определяли содержание катионов металлов. В опыте менялась температура: 25, 45, 600 С. Величину сорбции (CR , ммоль/г) рассчитывали по формуле:CR = (C-CS)* V/m , где - исходная концентрация ионов в растворе, моль/л; - равновесная концентрация ионов, моль/л; - объем раствора, мл; - масса катионита, г.
Обсуждение результатов
Для оценки сорбционных характеристик и подтверждения механизма сорбции ионов бария, меди и иттрия были сняты изотермы сорбции. На рис. 1 представлены изотермы сорбции исследованных ионов металлов из нитратных растворов.
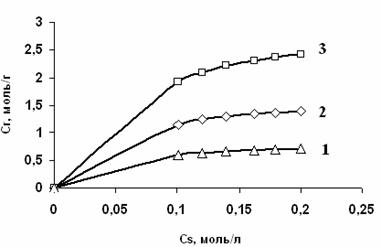
Рис. 1. Изотермы сорбции ионов иттрия (1), бария (2) и меди (3) из азотнокислых растворов карбоксильным катионитом КБ-4Пх2 в - форме при температуре 250С.
Из данных рис. 1 видно, что на начальных участках изотермы сорбции величина сорбируемости практически пропорциональна концентрации ионов в растворе (участок Генри), то есть при малых концентрациях в растворе наблюдается количественная сорбция. При высоких концентрациях ионов в растворе изотермы сорбции постепенно выходят на насыщение. С увеличением концентрации ионов металлов в растворе степень извлечения возрастает. Вид изотерм сорбции показывает, что кривая изотермы сорбции идет выше, чем для ионов бария и иттрия. Следовательно, сродство карбоксильного катионита КБ-4Пх2 к ионам меди выше.
Для определения значений констант, входящих в уравнения изотерм Ленгмюра и Фрейндлиха, можно использовать линейные формы уравнений данных моделей (уравнения (2) и (4) соответственно табл.1). Линейные уравнения Редлиха - Петерсона и Ленгмюра - Фрейндлиха не могут быть использованы для определения констант этого уравнения, так как они содержат три неизвестных параметра. В связи с этим для нахождения констант уравнений (1), (3), (5) и (7) использована процедура минимизации. Значения параметров, входящих в уравнения моделей, а также коэффициенты корреляции представлены в таблице 2.
Количественной мерой сродства сорбированного иона к поверхности катионита служит величина KF, входящий в уравнение изотермы Фрейндлиха. В таблице 2 приведены расчетные данные констант моделей изотерм. Значения величины KF подтверждают наибольшее сродство ионов меди к катиониту, чем сродство ионов бария и иттрия. На основании значений величины KF получаем ряд сродства, показывающий уменьшение степени сродства сорбированных ионов к поверхности катионита КБ-4Пх2 следующим образом:
Cu 2+ >Ba 2+ >Y 3+
Значения коэффициентов корреляции ( R2), приведенные в табл.2 показывают, что сорбция исследованных ионов металлов наилучшим образом описывается моделью Ленгмюра. Значение константы уравнения Редлиха - Петерсона близко к 1 для ионов иттрия, бария и меди подтверждает, что сорбция протекает по механизму Ленгмюра.
Таблица 2. Константы изотерм Ленгмюра, Фрейндлиха, Редлиха - Петерсона и Ленгмюра - Фрейндлиха
|
Модель Ленгмюра |
||||
|
ион |
KL |
S |
1/K*S |
R2 |
|
Ba 2+ |
18,8 |
1,773 |
0,03 |
0,999 |
|
Cu 2+ |
15,4 |
3,25 |
0,02 |
0,997 |
|
Y 3+ |
23,0 |
0,87 |
0,05 |
0,998 |
|
Модель Фрейндлиха |
||||
|
ион |
KF |
1/n |
n |
R2 |
|
Ba 2+ |
2,203 |
0,247 |
3,61 |
0,967 |
|
Cu 2+ |
4,13 |
0,328 |
3,05 |
0,979 |
|
Y 3+ |
1,034 |
0,23 |
4,348 |
0,985 |
|
Модель Редлиха - Петерсона |
||||
|
ион |
KR |
aR |
B |
R2 |
|
Ba 2+ |
34,13 |
18,77 |
0,987 |
0,983 |
|
Cu 2+ |
48,78 |
14,70 |
0,989 |
0,994 |
|
Y 3+ |
20,16 |
23,17 |
0,999 |
0,995 |
|
Модель |
||||
|
ион |
KLF |
aLF |
1/n |
R2 |
|
Ba 2+ |
30,36 |
16,82 |
0,964 |
0,984 |
|
Cu 2+ |
45,32 |
13,74 |
0,977 |
0,993 |
|
Y 3+ |
20,12 |
23,14 |
0,999 |
0,993 |
Заключение
Изотермы сорбции ионов меди, бария и иттрия на карбоксильном катионите КБ-4Пх2 были обработаны моделями изотерм сорбции Ленгмюра, Фрейндлиха, Редлиха - Петерсона и Ленгмюра - Фрейндлиха. Установлено, что сорбция исследованных ионов металлов наилучшим образом описывается моделью Ленгмюра, что соответствует образованию мономолекулярного сорбционного слоя и все сорбционные места обладают равной энергией сорбции.
Список литературы:
- Солдатов В.С., Бычков В.А. Ионообменные равновесия в многокомпонентных системах. Минск: Наука и техника, 1988. 359 с.
- Воюцкий С.С. Курс коллоидной химии. М.: Химия, 1976. 512с.
- Wong Y.C., Szeto Y.S., Cheung W.H. Equilibrium studies for acid dye absorption onto chitosan //Langmuir. 2003. v.19. P. 7888-7894.
- Redlich O., Peterson D.L. A useful absorption isotherm //J.Phys.Chem. 1959. v. 63. № 6. P.1024.
- Шванрценбах Г., Флашка Г. Комплексонометрическое титрование. М.: Химия, 1970. 360 с.
Библиографическая ссылка
Пимнева Л.А., Нестерова Е.Л. ИЗОТЕРМЫ СОРБЦИИ ИОНОВ БАРИЯ, МЕДИ И ИТТРИЯ НА КАРБОКСИЛЬНОМ КАТИОНИТЕ КБ-4ПХ2 // Современные наукоемкие технологии. 2008. № 4. С. 15-19;URL: https://top-technologies.ru/ru/article/view?id=23724 (дата обращения: 07.03.2026).