Антипирин и его конденсированные производные, несмотря на их высокую экстракционную способность, в экстракции хлоридных комплексов ртути(II) не изучались.
В настоящей работе приведены сведения о распределении ионов Hg(II) из хлоридных растворов в хлороформ в присутствии антипирина (АП) и его конденсированного производного - Диан-типирилметана (ДАМ).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Стандартный раствор сульфата ртути (0,1 моль/л) готовили растворением навески HgSO4 в 1 моль/л H2SO4. Титр определяли по методу [9]. Растворы с меньшей концентрацией получали разбавлением исходного соответствующей кислотой непосредственно перед экспери-ментом. В качестве экстрагентов приме-няли 0,005-0,1 моль/л растворы ДАМ и 0,05 - 1моль/л растворы АП в хлороформе.
Распределение ртути(II) проводили в делительных воронках при комнатной температуре при равных объемах фаз (V=10 мл) в течение 10 минут, которых достаточно для установления химического равновесия. Необходимую концентрацию ионов водорода создавали введением определенных количеств соответствующей кислоты. Полноту перехода макроколичеств ртути в органическую фазу контролировали титрованием ZnSO4 [9], предварительно реэкстрагировав ее избытком ЭДТА.
Для установления состава экстрагируемых соединений применяли методы изомолярных серий, насыщения, логарифмический метод, а также химический анализ экстракта на все компоненты.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕПри изучении влияния концентра-ции хлороводородной кислоты на коэффициент распределения Hg(II) (рис. 1 и 2) установлено, что лучшей экстракционной способностью обладает ДАМ. Оптимальной кислотностью водной фазы можно считать 0,5 моль/л HCl для ДАМ и 0,25 моль/л HCl для антипирина. При дальнейшем увеличении концентрации кислоты экстракционная емкость реагентов уменьшается. Для ДАМ это связано с переходом в двукислотную соль R·2HCl, не извлекающую ионы металлов, а для АП - со значительной растворимостью реагента и его комплексных соединений в кислых водных средах.
Как видно из рис. 2, по значению рН1/2 исследуемые реагенты расположены в последовательности: АП(1,35) < ДАМ(1,55). Изотермы экстракции ртути в хлороформ при оптимальной кислотности среды свидетельствуют о высокой емкости ДАМ. Так для 0,1 моль/л растворов реагента экстракционная емкость (г/л) составила: 1,61 (АП) и 9,33 (ДАМ).
Состав извлекаемых соединений в хлороформ установлен методами изомо-лярных серий и молярных отношений. Данные обоих методов (Hg:R=1:2) были подтверждены билогарифмической зави-симостью lgDHg - lgCR, которая показала, что тангенс угла наклона близок к 2. То есть и в этом случае соотношение R:Hg в комплексе равно 2. График зависимости lgСHg(в) - lgCHg(о) (tgα=1) свидетельствует об экстракции ртути в органический растворитель в виде мономера.
Дальнейший анализ насыщенного металлом экстракта с ДАМ дал следующие результаты:
Определяемый компонент:Hg(II) Cl-ДАМ H+
Найдено мл 0,1 моль/л: 4,8 19,45 9,55 19,5
Такие же результаты получены и для АП. То есть в хлороформ экстрагируется комплекс состава (RH)2[HgCl4], где R - ДАМ, АП.
Изучены ИК-спектры комплексных соединений АП и ДАМ с ртутью. В спектрах соединений в кристаллическом состоянии отсутствует характеристическая полоса поглощения валентных колебаний группы С=О при 1650-1660 см -1. Это свидетельствует о присоединении протона к кислороду карбонильной группы молекулы антипирина и его производного при образовании катиона (R·H)+. Это хорошо согласуется с характером антипиринового цикла, в котором наблюдается сильный сдвиг электронной плотности вдоль цепи сопряжения двойных связей к кислороду карбонильной группы. В области же валентных колебаний гидроксогруппы ОН - 3200-3400 см -1 появляются малоинтенсивные полосы. То есть АП и ДАМ являются типичными представителями анионообме-нных экстрагентов. В кислой среде они присоединяют протон к кислороду карбонильной группы, но при этом превращаются не в ониевый катион, а в катион аммония, способный экстраги-ровать металлокомплексные анионы. При прочих равных условиях наиболее эффективным экстрагентом является ДАМ. Это объясняется тем, что с увеличением молекулярной массы производного антипирина(ДАМ) уменьша-ется его гидрофильность, что ведет к увеличению экстрагируемости ионных ассоциатов.
Для расчета частных констант равновесия и приближенного значения константы распределения [HgCl4]2- использовали подход [1,8], согласно которому были определены значения концентраций реагента (ДАМ) и хлорид-ионов, отвечающие половинной экстракции комплексной соли (C(ДАМ) = 8,5·10-3 моль/л; C(Cl-) = 2,6·10-2 моль/л).
Расчет приближенного значения констан-ты распределения [HgCl4]2- осуще-ствляли согласно основному уравнению реакции образования комплекса: HgCl2(в) + 2Cl-(в) = HgCl42-(о). В результате константа образования и экстракции будет:
[HgCl4]2-(о) РКЭ= _________ = _____ , где(1) [HgCl2](в)∙[Cl-]2(в) КД
Р - константа распределения комплексного иона [HgCl4]2- ; КД - константа диссоциации его в водной фазе.
При равенстве концентраций HgCl2 в водной фазе и [HgCl4]2- в органической, а также исходя из уравнения (1), выражение для константы экстракции можно представить, как КЭ=1/[Cl-]2 =1,54·103. (2)
Из литературных данных [4] известно, что для [HgCl2] рК1,2=13,22, а для [HgCl42-] рК1,2,3,4=15,07. И тогда
[HgCl2]∙[Cl-]2К1,2,3,4
КД= ________ = ________ = 1,41·10-2 (3)
[HgCl42-] К1,2В таком случае константа распределения будет: Р(ДАМ) =КЭ·КД= 21,72. (4)
Экстракции ртути отвечает уравнение:
Hg2+(в) + 4Cl-(в) + 2R(о) + 2H+(в)↔ (RH)2[HgCl4](о) с константой равновесия:
[(RH)2[HgCl4] ](о) KР= ___(5)
[Hg2+](в) ∙[Cl-]4(в) ∙[R]2(о) ∙[H+]2(в)
При низких концентрациях реагента и хлорид-ионов константу экстракции можно представить зависимостью:
[ (RH)2[HgCl4] ](о)
KЭ=_______________ = KР∙[Cl-]4(в) ∙[R]2(о) ∙[H+]2(в) (6) [Hg2+](в)
В условиях половинной экстракции ртути, то есть при [(RH)2[HgCl4]]= [Hg2+] константа равновесия (KP) принимает вид:
K/Р=1/KР=[Cl-]4(в)[R]2(о)∙[H+]2(в) (7)
Согласно уравнению (7) для серии, например, с постоянной концентрацией хлорид-ионов можно записать K/Р = [R]2= 7,23·10-5 . Найденное таким образом значение K/Р , будет характеризовать частные константы равновесия для взаимодействия Hg2+ и реагента в двухфазной системе. И, напротив, для растворов с постоянной концентрацией реагента может определить значение K//Р=[Cl-]4 = 4,23·10-7 , характеризующее присоединение хлорид-иона к иону Hg2+ или к уже имеющемуся в растворе комплексному металлхлоридному иону.
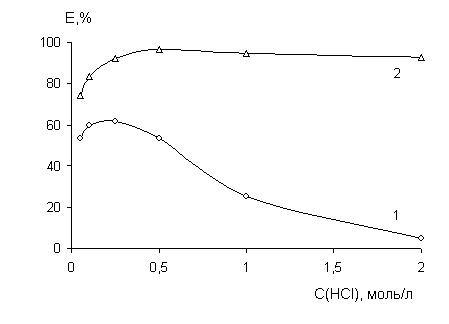
Рис. 1 Зависимость степени извлечения ртути (II) от концентрации HCl
(1 - Ант 0,25 моль/л; 2 - ДАМ 0,1 моль/л; C(Hg)=0,01 моль/л)
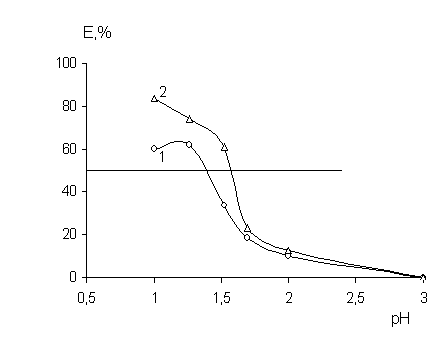
Рис. 2 Зависимость степени извлечения ртути (II) от рН (по HCl)
(1 - Ант 0,25 моль/л; 2 - ДАМ 0,1 моль/л; C(Hg)=0,01 моль/л)
СПИСОК ЛИТЕРАТУРЫ:
- Бабко А.К., Шевчук И.А., Дегтяренко Л.И.// Труды комиссии по аналитической химии. 1963. Т. 14. С.148.
- Золотов Ю.А., Иофа Б.З., Чучалин Л.К. Экстракция галогенидных комплексов металлов. М.: Наука, 1973. 379 с.
- Золотов Ю.А., Ванифатова Н.Г., Серякова И.В. Экстракция металлов нейтральными серусодержащими соедине-ниями. М.: Наука, 1980. 100 с.
- Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1971. 454 с.
- Пасекова Н.А., Плетнев И.В., Малхасян Е.В. // Журн. неорган. химии. 1991. Т. 36. № 11. С. 2971.
- Поддубных Л.П., Дмитриенко С.Г., Кузьмин Н.М., Формановский А.А., Золотов Ю.А. // Журн. неорган. химии. 1986. Т. 31. № 7. С. 1812.
- Поддубных Л.П., Дмитриенко С.Г., Кузьмин Н.М., Формановский А.А., Золотов Ю.А. // Заводская лаборатория. 1987. Т. 53. № 5. С. 1.
- Тананайко М.М.// Журн. неорган. химии. 1967. Т. 12. № 10. С. 2687.
- Шварценбах Г., Флашка Г. Комплексонометрическое титрование. М.:Химия, 1970. 380 с.
- Sato Tshichi, Sato Keiichi, Ishi Kawa Izumi, Enokida Toshio // Int. Solv. Extr. conf. 1990. (ISEC´90), Kyoto, July 16-21, 1990.
- Tandon S.N., Gupta C.B.// Talanta. 1971. V. 18. P. 109.
Библиографическая ссылка
Дегтев М.И., Нечаева Е.М. ЭКСТРАКЦИЯ РТУТИ(II) ИЗ ХЛОРИДНЫХ РАСТВОРОВ В ХЛОРОФОРМ В ПРИСУТСТВИИ АНТИПИРИНА И ДИАНТИПИПИРИЛМЕТАНА // Современные наукоемкие технологии. 2006. № 7. С. 27-31;URL: https://top-technologies.ru/ru/article/view?id=22987 (дата обращения: 06.02.2026).



