Введение
Интерес к кислород- и азотсодержащим гетероаналогам циклогексана обусловлен все более возрастающим значением этих соединений в тонком органическом синтезе (получение энантиомерных спиртов и полиенов, аминоспиртов, эффективных катализаторов), а также комплексом практически полезных свойств (биологически активные вещества, ингибиторы коррозии, компоненты полимерных и горюче-смазочных материалов [1,2]) и особенностями строения (электронные и стерические внутримолекулярные взаимодействия). В частности, замещенные 1,3-диоксаны и тетрагидро-1,3-оксазины используются в качестве гербицидов, стимуляторов роста, инсектицидов, репеллентов, зооцидов, фунгицидов и бактерицидов. Наличие антимикробной и противовоспалительной активности позволяет применять их в косметических препаратах и медицине. Последняя область представляет особый интерес из-за разнообразия обнаруженных фармакологических свойств: нейролептических, антигистаминных и спазмолитических, расширяющих коронарные сосуды, гипогликемических, анестезирующих и антихолинергических. Обсуждаемые соединения оказывают также анальгетическое, бронхорасширяющее и противоязвенное, антиконвульсивное и противоопухолевое, противозачаточное действия, могут использоваться также для лечения сердечной недостаточности, гипертонии, ожирения, при грибных отравлениях [1].
Однако надежное конформационное отнесение молекул рассматриваемых соединений, невзирая на большое число публикаций, в ряде случаев остается проблематичным, а порой и вовсе невозможным из-за неоднозначного понимания результатов эксперимента и противоречивых концепций, описывающих их конформационную динамику. Совершенно не исследовано и влияние на конформационные свойства обсуждаемых гетероциклов достаточно большой биомолекулы в системе "биологически активный субстрат - рецептор". Между тем знание основных принципов построения поверхности потенциальной энергии таких систем может объективно помочь в понимании тонких особенностей механизма действия лекарственных препаратов на их основе. В этой связи выявление основных закономерностей конформационной динамики 1,3 - диоксанов и тетрагидро-1,3 - оксазинов, а также моделирование взаимодействия молекул этих веществ с рецепторами остается очень важной и актуальной проблемой.
1. Моделирование поверхности потенциальной энергии изолированных молекул 1,3-диоксанов и тетрагидро-1,3-оксазинов
Нами с помощью эмпирического (ММ+), а также полуэмпирических и неэмпирических методов в рамках программного обеспечения HyperChem [3] исследована поверхность потенциальной энергии (ППЭ) молекул 1,3-диоксанов (I-III) и тетрагидро-1,3-оксазина (IV). Известно, что главному минимуму на ППЭ 1,3-диоксанов и тетрагидро-1,3-оксазинов отвечает конформер кресла, К (в случае соединения II - c преимущественно аксиальной ориентацией N-H протона, NHa)[4-7].
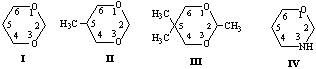
Методом ММ+ при использовании в качестве реакционной координаты отдельных внутрициклических торсионных углов показано, что при расчете изолированной молекулы 1,3-диоксана I в вакууме наиболее оптимальный маршрут инверсии цикла этого соединения: К ↔ К*- проходит через переходное состояние (ПС), отвечающее форме софы, С1 (табл.1).
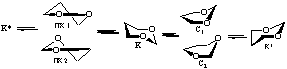
Таблица 1. Расчетные барьеры инверсии К↔К* (∆Е≠) диоксана I, ккал/моль
|
Угол |
1-6-4-3 |
1-2-4-5 |
3-4-5-6 |
2-3-4-5 |
1-2-3-4 |
2-1-6-4 |
1-2-3-5 |
4-5-6-2 |
|
∆Е≠ |
17.4 |
17.9 |
7.8 |
10.6 |
11.9 |
11.4 |
19.6 |
8.5 |
|
ПС |
ПК 1 |
ПК 1 |
С1 |
С2 |
ПК 2 |
ПК 2 |
С1 |
С1 |
|
ПМ |
2,5-Т |
1,4-Т |
1,4-Т |
1,4-Т |
2,5-Т |
1,4-Т |
1,4-Т |
1,4-Т |
Менее вероятны пути инверсии, идущие через ПС С2, ПК1 и ПК2 (формы полукресла). Экспериментальная величина ∆G≠ по данным [4] составляет 9.0-10.1 ккал/моль. Промежуточный минимум (ПМ) на ППЭ соответствует формам 1,4- либо 2,5-твист.
Исследование ППЭ соединения I с помощью полуэмпирических (АМ1 и РМ3) и неэмпирических (STO-3G и 6-31G) методов выявило более общую картину возможных конформационных превращений, а также характер промежуточных минимумов (ПМ) и переходных состояний (ПС) (табл.2).

Таблица 2. Энергетические параметры инверсии КÛК* (ккал/моль)
|
Методы |
Параметры |
2,5-Т |
1,4-Т |
ПС-1 |
ПС-2 |
| АМ1 |
ΔЕ ΔЕ¹ |
2,9 - |
2,3 - |
- 3,5 |
- 3,0 |
|
РМ3 |
ΔЕ ΔЕ¹ |
3,2 - |
2,9 - |
- 3,3 |
- 3,4 |
|
STO-3G |
ΔЕ ΔЕ¹ |
3,6 - |
4,5 - |
- 6,9 |
- 5,3 |
|
6-31G |
ΔЕ ΔЕ¹ |
4,4 - |
4,8 - |
- 8,7 |
- 5,0 |
Полученные данные свидетельствуют о двух вероятных путях конформационной изомеризации К↔К*, из которых в рамках полуэмпирических методов несколько более предпочтителен маршрут, идущий через промежуточный минимум 1,4-Т, а в неэмпирическом приближении - через 2,5-Т. Отмеченные гибкие формы способны превращаться друг в друга через переходное состояние ПС-2. Основному максимуму на ППЭ (ПС-1) отвечает форма софы.
В случае соединений II и III исследованы только два основных минимума, отвечающих конформерам кресла с аксиально и экваториально ориентированными заместителями (Ка и Ке соответственно).
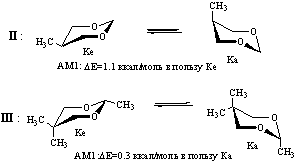
По данным литературы форма Ке более устойчива, чем Ка (величина ∆G0 С5-СН3 составляет 0.8-0.9 ккал/моль, а ∆G0 С2-СН3 - 3.6-4.1 ккал/моль [4]. Результаты расчетов показывают, что метод АМ1 достаточно корректно воспроизводит различия в энергии конформеров диоксана II, однако весьма неточен при оценке относительной стабильности форм Ка и Ке диоксана III, существенно завышая энергию экваториального конформера.
Исследование характера ППЭ молекул незамещенного тетрагидро-1,3-оксазина IV с помощью пакета HyperChem также выявило два вероятных маршрута конформационной изомеризации между невырожденными по энергии конформерами кресла Ка и Ке (форма Ка в согласии с данными ЯМР эксперимента более устойчива [5,6]). Полученные данные представлены в табл.3.

Таблица 3. Энергетические параметры инверсии Ка↔Ке (ккал/моль)
|
Методы |
Параметры |
Ка |
Ке |
1,4-Т |
2,5-Т |
ПС-1 |
ПС-2 |
ПС-3 |
| АМ1 |
ΔЕ ΔЕ¹ |
0 - |
4.9 - |
2.9 - |
3.7 - |
- 4.3 |
- 6.9 |
- 7.1 |
|
STO-3G |
ΔЕ ΔЕ¹ |
0 - |
3.1 - |
6.4 - |
6.1 - |
- 9.5 |
- 13.4 |
- 7.1 |
В этом случае на ППЭ присутствует три максимума; главному из них отвечает форма софы ПС-2. Кроме того, гибкие формы 1,4-Т и 2,5-Т способны превращаться друг в друга через переходное состояние ПС-3 [8].
2. Моделирование поверхности потенциальной энергии 1,3-диоксанов и тетрагидро-1,3-оксазина в присутствии гексапептидов
Известно, что существующие биорецепторы относятся к белкам; при этом молекула активного (в частности, лекарственного) субстрата связывается определенным участком белковой молекулы. Однако природа, структура и конкретный характер рецепторов, принимающих участие в связывании молекул 1,3-диоксанов и тетрагидро-1,3-оксазинов, неизвестны. Очевидно лишь, что биомолекула оказывает большое влияние на лекарственный субстрат, существенно перестраивая энергетику конформационных превращений последнего. В этой связи с целью моделирования взаимодействия в системе "рецептор - субстрат" на начальном этапе связывания, нами исследовано конформационное поведение молекул соединений I-IV в присутствии произвольных ациклического (П1) и циклического (П2) гексапептидов, построенных из остатков L-аминокислот, связанных по β-типу.
П1: ALA-GLY-SER-ASN-LEU-ASP
![]()
Сконструированные с помощью программного обеспечения HyperChem молекулы отмеченных гексапептидов с цвиттер-ионными концевыми группами, были оптимизированы в рамках эмпирической программы c силовым полем Amber, а затем - с помощью полуэмпирического метода АМ1. Далее в различных положениях вблизи молекулы гексапептида размещались 1,3-диоксаны I-III либо оксазин IV, предварительно оптимизированные в рамках АМ1, и система "гетероцикл - пептид" оптимизировалась с помощью приближения АМ1. Полученные результаты представлены в табл.4-7 и на рис.1-3.
Е (АМ1), ккал/моль
Гексапептид: -7476.45; ∑Е пепт. и Е цикл.
1,3-диоксан (кресло): -1321.55;∑= -8798.0
1,3-диоксан (1,4-Т): -1319.21;∑= -8795.66
1,3-диоксан (НВ): -1318.56; ∑=-8795.01
Таблица 4. Система: гексапептид П1- 1,3-диоксан
|
№ системы |
Конформация 1,3-Д |
-Е (ккал/моль) |
∆Е |
|
1 |
кресло |
8801.26 |
3.3 |
|
2 |
кресло |
8803.78 |
5.8 |
|
3 |
кресло |
8806.63 |
8.6 |
|
4 |
1,4-T |
8807.88 |
12.2 |
|
5 |
2,5-T→1,4-T |
8797.98 |
0.0 |
|
6 |
2,5-T→1,4-T |
8807.03 |
11.4 |
|
7 |
1,4-T |
8802.75 |
7.1 |
|
8 |
1,4-T→HB |
8805.45 |
10.4 |
Тетрагидро-1,3-оксазин (кресло, NH a): -1376.97; ∑=-8853.42;
Тетрагидро-1,3-оксазин (кресло, NH e): -1372.07;∑= -8848.52;
Тетрагидро-1,3-оксазин (1,4-твист, NHa): -1374.03;∑= -8850.48;
Таблица 5. Система: гексапептид П1 - тетрагидро-1,3-оксазин
|
№ системы |
Конформация 1,3-ОЗ |
-Е (ккал/моль) |
∆Е |
|
1 |
кресло NH a |
8862.20 |
8.8 |
|
2 |
кресло NH e |
8853.92 |
5.4 |
|
3 |
кресло NH a |
8859.71 |
6.3 |
|
4 |
1,4-T |
8860.18 |
9.7 |
|
5 |
1,4-T |
8863.16 |
12.7 |
Нетрудно видеть, что для системы "П1 - 1,3-диоксан" наблюдается ряд важных закономерностей:
- Выигрыш в энергии ∆Е (по сравнению с суммой энергий изолированных молекул гексапептида и 1,3-диоксана) существенно зависит от взаимного расположения молекул и уменьшается в случае расположения диоксана со стороны цвиттер-ионных концевых групп.
- Нивелируются различия в энергии между креслом и гибкой формой 1,4-Т (последняя обуславливает максимальное значение ∆Е, табл.4); в то же время конформер, отвечающий другому промежуточному минимуму - 2,5-Т - не реализуется вовсе, а в ходе оптимизации превращается в 1,4-Т.
- За счет межмолекулярных водородных связей становится возможной стабилизация формы, соответствующей переходному состоянию между 1,4-Т и 2,5-Т конформерами (несимметричная ванна НВ, рис.2).
Несколько иные закономерности наблюдаются в системе "П1 - тетрагидро-1,3-оксазин": уменьшение различий в энергии между аксиальным и экваториальным конформерами кресла и увеличение ∆Е между формами Ка и 1,4-Т (данные получены для соответственно одинаковых взаимных позиций оксазина и гексапептида (табл.5).
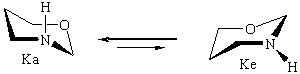
В вакууме: ∆E(NHa-NHe) = 4.9 ккал/моль
В прис. гексапептида: ∆E(NHa-NHe) = 3.4 ккал/моль
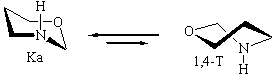
В вакууме: ∆E(К NHa-1,4-Т NHа) = 2.9 ккал/моль
В прис. гексапептида: ∆E(К NHa-1,4-Т NHа) = 3.9 ккал/моль
Общая картина взаимного расположения молекул насыщенного гетероцикла (на примере 1,3-диоксана) и гексапептида иллюстрируется рис.1:
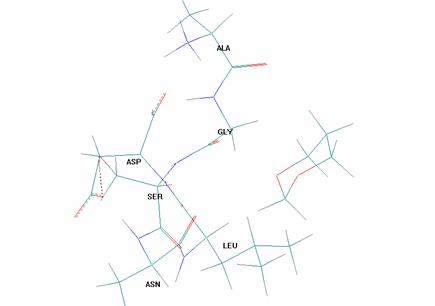
Рисунок 1. Общая картина взаимного расположения молекул насыщенного гетероцикла
На рис. 2 представлен пример стабилизации ПС - конформации НВ - за счет межмолекулярной водородной связи (показана пунктиром):
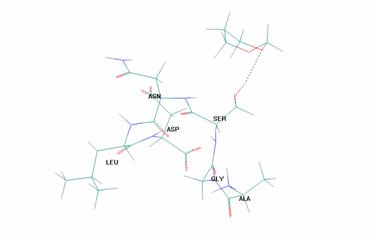
Рисунок 2. Пример стабилизации ПС - конформации НВ - за счет межмолекулярной водородной связи (показана пунктиром)
Для случая координации двух молекул 1,3-диоксана с пептидом П1 выигрыш в энергии составляет 17.1 ккал/моль (рис.3):
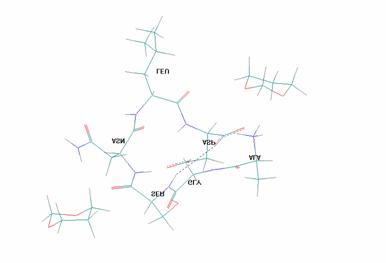
Рисунок 3. Координации двух молекул 1,3-диоксана с пептидом П1 выигрыш в энергии
В случае системы "П2 - 1,3-гетероцикл" с циклическим гексапептидом выигрыш в энергии для 1,3-диоксанов I-III сравним с наблюдаемым для системы с пептидом П1; в то же время различие в энергии аксиальных и экваториальных конформеров соединений II и III (∆Е´) по сравнению с рассчитанным для изолированных молекул заметно возросло (табл.6).
Таблица 6. Система: гексапептид П2 - 1,3-диоксаны I (№ 1-3), II (№ 4,5) и III (№ 6,7)
|
№ системы |
Конформация 1,3-Д |
-Е (ккал/моль) |
DЕ |
∆E´* |
|
1 |
кресло |
12246.40 |
4.4 |
- |
|
2 |
кресло |
12249.19 |
7.2 |
- |
|
3 |
кресло |
12248.09 |
6.1 |
- |
|
4 |
кресло е |
12531.40 |
8.8 |
1.0 |
|
5 |
кресло а |
12530.43 |
9.0 |
|
|
6 |
кресло е |
13086.32 |
8.2 |
1.1 |
|
7 |
кресло а |
13087.39 |
8.9 |
* В пользу Ке для диоксана II и Ка для диоксана III.
Для оксазина IV система с пептидом в ряде случае менее выгодна по сравнению с суммой энергий изолированных молекул (отрицательные значения ∆Е, табл.7).
Таблица 7. Система: гексапептид П2 - 1,3-тетрагидрооксазин
|
№ системы |
Конформация 1,3-Ox |
-Е (ккал/моль) |
DЕ |
|
1 |
кресло |
12299.23 |
1.8 |
|
2 |
кресло |
12290.75 |
-6.6 |
|
3 |
кресло |
12289.31 |
-8.1 |
|
4 |
кресло |
12300.06 |
2.7 |
|
5 |
1,4-Т |
12298.98 |
1.6 |
|
6 |
1,4-Т |
12295.14 |
-2.3 |
|
7 |
1,4-Т |
12300.39 |
3.0 |
|
8 |
1,4-Т |
12296.79 |
-0.6 |
Наименьшее расстояние между молекулой гетероцикла и ближайшим фрагментом гексапептида во всех случаях составляет 2.2-2.3 Å, что является типичным для длины межмолекулярной водородной связи в большинстве органических молекул.
Полученные данные свидетельствуют о существенном влиянии молекулы пептида на характер конформационной изомеризации исследованных 1,3-гетероциклов и показывают, что в процесс связывания модельных соединений с биомолекулой вовлечены не только стабильные конформеры, но и формы, соответствующие локальным максимумам на ППЭ.
СПИСОК ЛИТЕРАТУРЫ
- Итоги науки и техники. Технология органических веществ. Т.5. Химия и технология 1,3-диоксациклоалканов /Д.Л. Рахманкулов, Р.А. Караханов, С.С. Злотский и др. //М.: ВИНИТИ, 1979. - 288 с.
- Романов И.А., Талипова Г.Р., Ханченко М.В. и др. //Основной органический синтез и нефтехимия. Сб. научн. трудов. Вып. 26. Ярославль, 1990. - С.118-130.
- HyperChem 5.02. Trial version. http://www.hyper.com/.
- Внутреннее вращение молекул /под ред. В.Дж. Орвилл-Томаса. М.: Мир, 1975. - С.355.
- Cook M.J., Jones R.A.Y., Katritzky A.R. et al. //J. Chem. Soc. Perkin Trans. - 1973. - N 4. - P.325-331.
- Ferguson I.J., Katritzky A.R., Read D.M. //J. Chem. Soc. Chem. Comm. - 1975. - N 7. - P.255-256.
- Файзуллин А.А. Материалы XXXVIII международной научной студенческой конференции "Студент и научно-технический прогресс". Химия. Новосибирск, 2000. - С.141.
- Файзуллин А.А., Бочкор С.А., Кузнецов В.В. Четвертая Всероссийская научная internet-конференция "Компьютерное и математическое моделирование в естественных и технических науках". Тамбов, 2002. - Вып.18. - С.55.
Библиографическая ссылка
Курамшина А.Е., Бочкор С.А., Кузнецов В.В. МОДЕЛИРОВАНИЕ ПОВЕРХНОСТИ ПОТЕНЦИАЛЬНОЙ ЭНЕРГИИ НАСЫЩЕННЫХ 1,3-ГЕТЕРОЦИКЛОВ В ПРИСУТСТВИИ МОЛЕКУЛЫ ГЕКСАПЕПТИДА // Современные наукоемкие технологии. 2006. № 4. С. 8-13;URL: https://top-technologies.ru/ru/article/view?id=22609 (дата обращения: 27.12.2025).



