Энергетический обмен миокарда примерно на 85 % осуществляется при участии кислорода, то есть носит преимущественно аэробный характер. В состоянии относительного покоя миокард потребляет 8-10 мл кислорода на 100 г ткани, что примерно в 15 раз выше, чем средний уровень потребления кислорода другими органами и тканями (Кошелев В.Б., 2005). Основным энергетическим субстратом для миокардиоцита в условиях нормы являются нейтральные жиры и жирные кислоты, обеспечивающие процессы энергообеспечения более чем на 70%. В меньшей степени энергообеспечение миокарда осуществляется за счет глюкозы и гликолитических реакций, а также аминокислот и белков. К метаболическим особенностям миокарда относится отсутствие в нем запасов АТФ, креатинфосфата и кислорода, которых в случае развития ишемии миокарда хватает лишь на очень короткое время [6].
Содержание свободного кислорода в миокарде составляет примерно 0.07 мл и связанного с миоглобином - 0.5 мл. Как известно, в условиях физической нагрузки минутный объем крови (МОК) может возрастать примерно в 10 раз, что требует увеличения энергообеспечения и возрастания доставки кислорода. Последнее достигается за счет интенсификации коронарного кровотока. Как известно, при отсутствии выраженных склеротических изменений в структуре коронарных сосудов соответствие коронарного кровотока энергетическим потребностям миокарда обеспечивается за счет адаптивной дилатации сосудов, исходно обладающих высоким базальным тонусом.
Установлено, что в состоянии относительного покоя через коронарные сосуды протекает 200-250 мл/мин крови, что составляет 4-6 % общего МОК. Во время физической нагрузки коронарный кровоток возрастает в 10-15 раз. Интенсификация коронарного кровотока при возросших энергетических потребностях регулируется на клеточном, органном и системном уровнях за счет усиления образования метаболитов изнашивания, в частности, аденозина, углекислого газа, водорода, а также гормональных и нервных влияний [11]. Мощным коронародилатирующим эффектом обладают биологически активные соединения, образующиеся при гипоксии миокарда, развитии в нем деструктивных изменений; к ним относятся: простациклин, простагландины А, Е, оксид азота (NO), вазоактивный интестинальный пептид (ВИП), ко-кальцигенин, предсердный натрийуретический фактор и др. [5].
Важную роль в адаптивных реакциях коронарного кровотока на повышенную нагрузку отводят вегетативным нервным влияниям. Так, активация холинэргических влияний на миокард приводит к дилатации коронарных сосудов за счет усиления продукции NO эндотелием [5,6]. Нейрогенная симпатическая коронародилатация обеспечивается за счет функционального симпатолиза, когда вазоконстрикторным эффектам катехоламинов противодействует избыточное образование метаболитов изнашивания в процессе возрастания сократительной способности миокарда, реализующейся при участии β1 - адренорецепторов. Несмотря на довольно широкие адаптивные возможности коронарного кровотока, развитию реакций адаптации в условиях патологии препятствуют структурные нарушения коронарных сосудов. В то же время ряд анатомо-физиологических особенностей миокарда и коронарных сосудов, не проявляющихся развитием реакции дезадаптации в условиях нормы, могут быть отнесены к факторам риска трансформации реакций адаптации в реакции повреждения в условиях патологии [4,7,8]. Об этом свидетельствуют следующие факты:
- Коронарные сосуды являются сосудами концевого типа с абсолютной недостаточностью коллатералей. Последние (диаметром 100 мкм) имеются лишь в зонах терминалей коронарных сосудов, поэтому ограничение кровотока по магистральным сосудам приводит к развитию коронарогенного некроза миокарда.
- В условиях ишемии миокарда возникает болевой синдром и соответственно активация симпато-адреналовой системы. Усиление адренэргических влияний на миокард, как известно, характеризуется тахикардией и соответственно укорочением диастолы, а также резким ограничением коронарного кровотока. Последний примерно на 85% реализуется в условиях диастолического расслабления миокарда.
- Адаптивная активация симпато-адреналовой системы при ишемии миокарда приводит к усилению свободно-радикального окисления, дальнейшей дестабилизации клеточных мембран сосудистой стенки, сдвигам коагуляционного потенциала, реалогических свойств крови.
- Разрушение, десквамация эндотелия коронарных сосудов при их атеросклеротическом поражении, чрезмерное накопление йонов водорода в ишемизированном миокарде сопровождаются извращением вазогенных эффектов биологически активных соединений, медиаторов, гормонов.
- В ишемизированном миокарде нарушается сопряжение процессов возбуждения и сокращения, что препятствует развитию «функционального симпатолиза» и соответственно усиление адренэргических влияний на миокард приводит к реализации коронароспастического эффекта через α - адренорецепторы сосудистой стенки.
Целью настоящих исследований явилось изучение характера нарушений энергообеспечения миокарда в условиях экспериментальной ишемии, в частности, установление патогенетической взаимосвязи изменений уровня макроэргов и активности дегидрогеназ (сукцинатдегидрогеназы (СДГ), лактатдегидрогеназы (ЛДГ) в динамике патологии, что позволит патогенетически обосновать новые способы медикаментозной коррекции метаболических расстройств в ишемизированном миокарде.
Материалы и методы. Эксперименты по изучению метаболических особенностей миокарда в норме и при патологии проведены на 80 беспородных белых крысах самцах массой 250-300 г.
В гомогенатах миокарда изучено содержание АТФ и креатинфосфата с помощью наборов Био-Ла-Тест чешской фирмы «Лахема». Одновременно проведена оценка активности ряда ферментов гомогенатов миокарда и сыворотки крови, участвующих в процессах энергообеспечения миокарда - сукцинатдегидрогеназы (СДГ), лактатдегидрогеназы (ЛДГ) [2,3], а также аспартатаминотрансферазы (АсАТ) (с помощью наборов Био-Ла-Тест чешской фирмы «Лахема»).
Сравнительные серии экспериментов проведены в группе интактных животных, ложнооперированных животных и в группе животных с окклюзией коронарной артерии, достигаемой по методу H.Selye. в модификации Саидова А.Б. и соавторов [9].
Результаты и их обсуждение. Как известно, источником образования АТФ в миокарде являются процессы окислительного фосфорилирования и свободного дыхания, сопряженные на внутренней мембране митохондрий. Установлено, что АТФ обладает низкой миграционной способностью к местам энергетических трат, в частности, к миозину, актину, цитоплазматической мембране, саркоплазматическому ретикулуму и др. Доставка макроэргических связей к указанным структурам обеспечивается в процессе перифосфорилирования АТФ с креатином с участием креатинфосфокиназы и за счет последующего транспорта креатинфосфата к местам энергетических трат. В связи с этим представляло интерес изучение соотношения АТФ и креатинфосфата в миокарде в динамике ишемии [8].
Как оказалось, спустя 60 мин. с момента развития ишемии параллельно со снижением содержания в гомогенатах миокарда АТФ (р<0.01, рис.1) отмечается и снижение уровня креатинфосфата (р<0.01, рис.2) по сравнению с таковыми показателями групп интактных и ложнооперированных животных. Выявленная закономерность свидетельствует, с одной стороны, об усилении энергетических трат, а с другой - о резком подавлении сопряженных с дыханием реакций окислительного фосфорилирования и перифосфорилирования креатина с участием креатинфосфокиназы. При последующих наблюдениях, спустя 72 часа с момента развития острой ишемии имело место прогрессирующее снижение уровня АТФ (р<0.001, рис. 1) и падение уровня креатинфосфата в гомогенатах миокарда (р<0.001, рис. 2) по сравнению с таковыми показателями не только групп интактных и ложнооперированных животных, но и по отношению к предшествующей группе наблюдения с более ранним сроком развития острой ишемии миокарда.
Как известно, при гипоксических состояниях изменяется характер энергетического обеспечения миокарда: основным энергетическим субстратом становится лактат. Причем, в условиях нормы энергетический выход на 1 молекулу глюкозы в процессе гликолиза составляет 2 М АТФ, а при аэробном окислении 1 молекула глюкозы является источником образования 36 М АТФ.
В связи с этим представлялось целесообразным сопоставить состояние активности дегидрогеназ гомогенатов миокарда и сыворотки крови (ЛДГ и СДГ - важнейших ферментов гликолиза и цикла Кребса) в динамике острой ишемии миокарда.
Как известно, ЛДГ миокарда обладает достаточно высокой активностью и не относится к лимитирующим ферментам гликолиза, катализирует обратимую реакцию взаимопревращения лактата и пирувата:
Лактат + NAD+↔ Пируват + NADH+ + Н+
В условиях адекватной оксигенации и при высокой скорости поглощения лактата равновесие смещается в сторону образования пирувата. При гипоксии, когда происходит накопление NAD+ и Н+, пируват не может быть дегидрогенизирован и реакция сдвигается в сторону образования лактата [8].
Как показали результаты проведенных нами исследований, спустя 60 мин с момента развития ишемии, активность ЛДГ гомогенатов миокарда (рис.3) и сыворотки крови (рис. 6) не отличалась от таковых показателей групп интактных и ложнооперированных животных. Резкое снижение активности ЛДГ гомогенатов миокарда отмечено лишь спустя 72 часа с момента развития острой ишемии миокарда (р<0.001, рис. 3). Одновременно имело место возрастание активности ЛДГ (р<0.001, рис. 7) сыворотки крови, что является, по-видимому, одним из проявлений синдрома цитолиза.
Касаясь значимости выявленного нами феномена, следует отметить, что в условиях ишемии резко изменяется характер субстратов, используемых миокардом в целях энергетического обеспечения. Как известно, лактат и свободные жирные кислоты конкурируют за поглощаемый миокардом кислород. Причем свободные жирные кислоты ингибируют окисление глюкозы в условиях нормы и являются основным энергетическим субстратом для интактного миокарда. Возможный механизм угнетения лактата свободными жирными кислотами в норме заключается в ингибировании ферментного компонента пируватдегидрогеназы [8]. В условиях ишемии миокарда резко возрастает образование лактата, что приводит к конкурентному вытеснению лактатом жирных кислот в энергетическом обеспечении миокарда. При этом доля лактата, как субстрата синтеза макроэргов в миокарде взрастает до 65-90%. Возможный механизм угнетения лактатом метаболизма свободных жирных кислот состоит в ингибировании активационного влияния тиокиназы [8]. Таким образом, выявленная нами достаточно высокая активность ЛДГ гомогенатов миокарда, спустя 60 мин с момента развития острой ишемии миокарда, является одним из показателей изменения характера энергетического обеспечения миокарда. Спустя 72 часа с момента развития ишемии, возникает недостаточность энергетического обеспечения миокарда при участии лактата, на что косвенно указывает подавление активности ЛДГ.
Установлено, что какой бы субстрат не поглощался из крови миокардом, существуют метаболические пути упрощения этого субстрата и превращения его в ацетил-СоА. Последний вступает в цикл лимонной кислоты Кребса, где происходит ряд реакций дегидрогенизации, при каждой из которой от субстрата отщепляется 2 протона и происходит восстановление NAD+ до NADH++. Восстановленные эквиваленты NADH++ поступают в цепь переноса электронов, где образуется АТФ и, наконец, электроны переносятся на атомы кислорода с образованием воды [8].
Одним из важнейших ферментов цикла Кребса является СДГ - флавопротеин, прочно связанный с внутренней митохондриальной мембраной, катализирует дегидрирование сукцината с образованием фумарата.
Как показали результаты проведенных нами исследований, спустя 60 мин с момента развития острой ишемии миокарда, возникало выраженное снижение активности СДГ (р<0.01, рис.4) по сравнению с таковыми показателями в группах интактных и ложнооперированных животных. Спустя 72 часа с момента развития острой ишемии, активность фермента оставалась сниженной, как и в предыдущий период наблюдения (р<0.001, рис.4).
Как известно, конкурентным ингибитором СДГ является малонат. В свою очередь малоновая кислота образуется из ацетил-СоА и СО2, представляет собой трехуглеродную молекулу, являющуюся субстратом синтеза жирных кислот в виде тиоэфира - малонила-СоА. Установлено, что α - метилмалонил-СоА в результате необычной внутримолекулярной перестройки превращается в сукцинил-СоА - один из промежуточных продуктов цикла Кребса [8].
Таким образом, возможно предположить, что усиление конкурентного использования лактата миокардом в условиях ишемии в качестве основного источника синтеза макроэргических фосфатных связей, приводит к избыточному накоплению малоната - трехуглеродного предшественника синтеза жирных кислот. Последний в свою очередь подавляет активность СДГ, тем самым, блокируя центральные звенья цикла Кребса.
Одним из направлений данной работы явилось изучение активности АсАТ миокарда и сыворотки крови в динамике острой ишемии миокарда. Как известно, трансаминазы обеспечивают перенос α-аминогрупп от аминокислоты на α-углеродный атом α-кетоглутамата в результате чего образуются α-кетоаналоги исходной аминокислоты и α-глутамат. Таким образом, α-глутамат является коллектором аминогрупп от разных аминокислот, направляющим аминогруппы на необходимые для клетки биосинтетические процессы [8].
В результате проведенных нами исследований отмечено прогрессирующее снижение активности АсАТ гомогенатов миокарда (р <0.001, рис. 5), проявляющееся уже спустя 60 мин с момента развития острой ишемии и достигающее максимума (р<0.001, рис.5) через 72 часа с момента развития острой ишемии. Обнаруженное нами торможение активности трансаминаз может служить косвенным показателем нарушения окислительных процессов в цикле Кребса, поскольку необходимые для переаминирования альфа-кетокислоты (пировиноградная, альфа-кетоглутаровая, щавелевоуксусная) обеспечиваются реакциями цикла трикарбоновых кислот.
В динамике острой ишемии миокарда наблюдается прогрессирующее повышение активности АсАТ (р<0.001, рис. 6) сыворотки крови, что является, в соответствии с многочисленными данными литературы, общепризнанным критерием процессов цитолиза.
Выводы:
- Характерной особенностью нарушений метаболизма в ишемизированном миокарде является одновременное прогрессирующее снижение содержания АТФ и креатинфосфата.
- Подавление активности СДГ гомогенатов миокарда в условиях острой ишемии опережает во времени подавление активности ЛДГ.
- Выявлена диссоциация изменений ферментативной активности ЛДГ и АсАТ гомогенатов миокарда и сыворотки крови: возрастание активности указанных ферментов сыворотки крови на поздних сроках развития ишемии миокарда имеет отрицательную корреляцию со снижением активности этих ферментов в гомогенатах миокарда.
- Избыточное потребление лактата в период острой ишемии миокарда в качестве основного субстрата синтеза макроэргических соединений приводит, по-видимому, к конкурентному вытеснению из метаболических реакций жирных кислот, избыточному накоплению малоната - трехуглеродного субстрата синтеза жирных кислот. В свою очередь, малонат является основным ингибитором активности СДГ. При этом возникают обрыв промежуточных реакций цикла Кребса и соответственно подавление вовлечения ацетил-СоА - в цикл трикарбоновых кислот, дальнейшая блокада энергетического обеспечения миокарда.
- Одним из интегративных показателей оценки ишемии миокарда является нарушение трансаминирования аминокислот и недостаточность коллекторного накопления аминогрупп в миокарде в виде α-глутаминовой кислоты, о чем свидетельствует прогрессирующее снижение активности АсАТ гомогенатов миокарда в условиях острой ишемии миокарда.
- Медикаментозная коррекция метаболических расстройств ишемизированного миокарда должна включать использование макроэргических соединений: креатинфосфата, АТФ, рибофлавина - предшественника АТФ, обладающих коротким биологическим эффектом в связи с реакциями дефосфорилирования. Пролонгирование эффектов макроэргов может быть достигнуто за счет активации сукцинатдегидрогеназы, а также при использовании синтетического переносчика кислорода по типу убихинона, витаминов В2, В6 в сочетании с сукцинатом или его предшественниками: аланином, малатом, глутаматом. Оптимальное соотношение антиоксидантов и антигипоксантов имеет место в цитофлавине - препарате фирмы «Полисан», который в последнее время находит широкое применение в практике лечения ишемических повреждений миокарда и нарушений мозгового кровообращения [1,10].
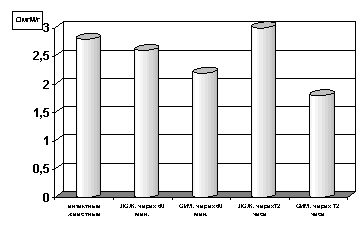
Рисунок 1. Содержание АТФ в гомогенате миокарде в условиях острой ишемии миокарде.
Примечание: ЛОЖ - лоднооперированные животные и ОИМ - острая ишемия миокарда, спустя 60 мин. и 72 часа с момента острой ишемии.
Степень достоверности полученных данных указаны в тексте.
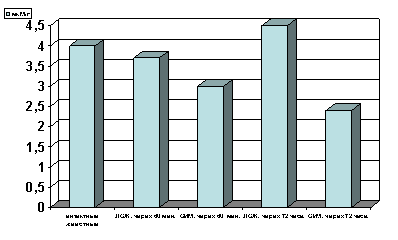
Рисунок 2. Содержание КФ в гомогенате миокарде в условиях острой ишемии миокарде.
Примечание: ЛОЖ - лоднооперированные животные и ОИМ - острая ишемия миокарда, спустя 60 мин. и 72 часа с момента острой ишемии.
Степень достоверности полученных данных указаны в тексте.
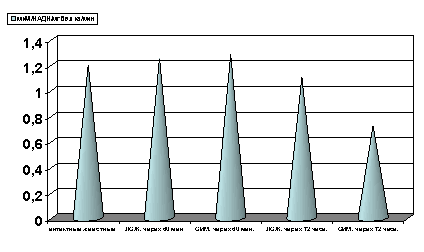
Рисунок 3. Содержание ЛДГ в гомогенате миокарде в условиях острой ишемии миокарде.
Примечание: ЛОЖ - лоднооперированные животные и ОИМ - острая ишемия миокарда, спустя 60 мин. и 72 часа с момента острой ишемии.
Степень достоверности полученных данных указаны в тексте.
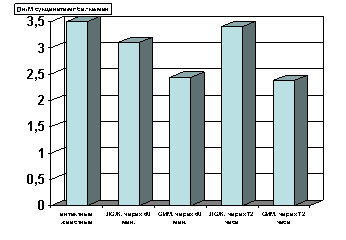
Рисунок 4. Содержание СДГ в гомогенате миокарде в условиях острой ишемии миокарде.
Примечание: ЛОЖ - лоднооперированные животные и ОИМ - острая ишемия миокарда, спустя 60 мин. и 72 часа с момента острой ишемии.
Степень достоверности полученных данных указаны в тексте.
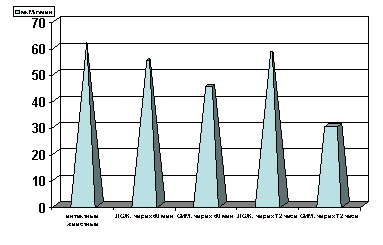
Примечание: ЛОЖ - лоднооперированные животные и ОИМ - острая ишемия миокарда, спустя 60 мин. и 72 часа с момента острой ишемии.
Степень достоверности полученных данных указаны в тексте.
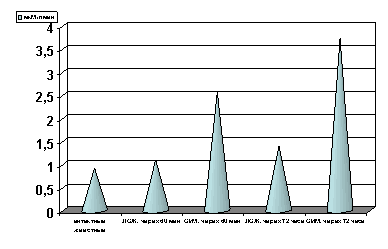
Рисунок 6. Содержание АсАТ в сыворотке крови в динамике острой ишемии миокарде.
Примечание: ЛОЖ - лоднооперированные животные и ОИМ - острая ишемия миокарда, спустя 60 мин. и 72 часа с момента острой ишемии.
Степень достоверности полученных данных указаны в тексте.
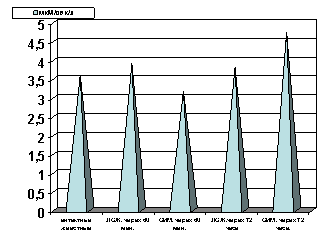
Рисунок 7. Содержание ЛДГ в сыворотке крови в динамике острой ишемии миокарде.
Примечание: ЛОЖ - лоднооперированные животные и ОИМ - острая ишемия миокарда, спустя 60 мин. и 72 часа с момента острой ишемии.
Степень достоверности полученных данных указаны в тексте.
СПИСОК ЛИТЕРАТУРЫ.
- Бульон В.В., Хныченко Л.К., Сапронов Н.С., Коваленко А.Л., Алексеева Л.Е. Использование цитофлавина для коррекции последствий ишемического повреждения миокарда //Экспериментальная и клиническая фармакология. - 2002. - Том 65, №1. с. 27-29.
- Ещенко Н.Д., Прохорова М.И. Методы биохимических исследований - ЛГУ, Ленинград, 1982. - с.224-226
- Ещенко Н.Д., Вольский Г.Г., Прохорова М.И. Методы биохимических исследований - ЛГУ, Ленинград, 1982. - с. 210-212.
- Зайчик А.Ш., Гурилов Л.П. Основы общей патологии. Часть 2. /А.Ш. Зайчик, Л.П. Гурилов. - Основы патохимии. - СПб.: ЭЛБИ, 2000. - 687с. - с.363-364.
- Игнарро Л. Дж. Физиология и патофизиология оксида азота /Л. Дж. Игнарро //Актуальные проблемы анестезиологии и реаниматологии: Сб. науч. тр. - Архангельск: Тромсе, 1997. - с.266-269.
- Логинов А.С., Б.Н. Матюшин. Цитотоксическое действие активных форм кислорода и механизм развития хронического процесса в печени при ее патологии /А.С. Логинов, Б.Н. Матюшин //Патологическая физиология и экспериментальная терапия. - 1996. - №4 - с. 3-6.
- Окороков А.И. Диагностика болезней сердца и сосудов /А.И. Окороков //Диагностика болезней внутренних органов: Т. 6. - М.: Мед. лит., 2002. - 464 с.: ил. - с. 92-114.
- Патологическая физиология и биохимия: Учебное пособие для ВУЗов /- М.: Издательство «Экзамен». 2005. - 480с. - с.140-151.
- Саидов А.Б., Каримов Х.Я., Юлдашев Н.М., Саидов С.А. //Успехи современного естествознания. - 2006. - №3. с. 33-35.
- Скоромец А.А., Никитина В.В., Голиков К.В. Эффективность цитофлавина в постинсультном периоде ишемического нарушения мозгового кровообращения. //Медицинский академический журнал. - 2003. - Том 3, №2. с.90-97.
- Чазов Е.И. Структура и функция сердечно-сосудистой системы в норме и при патологии /Е.И. Чазов //Руководство по кардиологии /- М.: «Медицина». 1982. - с.336-350.
Библиографическая ссылка
Бизенкова М.Н., Чеснокова Н.П., Романцов М.Г. СРАВНИТЕЛЬНАЯ ОЦЕНКА ЭНЕРГООБЕСПЕЧЕНИЯ МИОКАРДА В НОРМЕ И В ДИНАМИКЕ ЭКСПЕРИМЕНТАЛЬНОЙ ОСТРОЙ ИШЕМИИ // Современные наукоемкие технологии. 2006. № 1. С. 21-27;URL: https://top-technologies.ru/ru/article/view?id=22311 (дата обращения: 07.03.2026).



