Разделы «гетерогенные химические реакции в растворах» и «синтез высокодисперсных частиц» лабораторного практикума по курсу химии для студентов технических специальностей могут быть дополнены работой по изучению процесса получения высокодисперсного карбоната кальция, содержащей элементы научного исследования. Работа актуализирует знания по физике, физической химии и химии гетерогенных процессов. Использование междисциплинарного подхода позволяет проводить работу как в базовом, так и в углубленном варианте с использованием кейс-метода [1], сочетающего в себе различные виды практической деятельности и являющегося практико-ориентированным [2], так как синтез высокодисперсных материалов широко применяется в современных технологических процессах [3, 4]. Такую работу целесообразно проводить после освоения теоретического материала и выполнения соответствующего домашнего задания [5], с использованием объектно-ориентированных обучающих материалов [6]. Выбор карбоната кальция в качестве объекта студенческого практикума продиктован его безопасностью, что позволяет проводить работу в лаборатории на лабораторных столах. Гидроксид кальция и углекислый газ являются доступными и недорогими реактивами, свойства которых хорошо известны студентам из школьного курса химии. Высокодисперсный и ультрадисперсный карбонат кальция находит широкое применение как наполнитель, загуститель[7], депо для индикаторов [8] и лекарственных средств [9].
При формировании химических компетенций выделяются три компонента [10]: когнитивный, деятельно-практический и личностно-мотивационный. Компетентностный подход концентрирует внимание на развитии и оценивании уровня выраженности каждого компонента. Когнитивный компонент базируется на наборе знаний об используемых материалах. В данном случае они хорошо известны обучающимся студентам из курса химии средней школы. Деятельностно-практический компонент опирается на сформированные предметные умения осуществления гетерогенных реакций, фильтрации продукта, его высушивании и взвешивании. Также осуществляется формирование нового для учащихся навыка микроскопического исследования с составлением гистограммы распределения частиц по размерам и её анализа. Личностно-мотивационный основывается на несомненной пользе метода, подкрепляется широким использованием продукта в различных целях, простым и очевидным способом контроля качества получаемого высокодиспресного карбоната кальция. Все стадии эксперимента наглядны, безопасны и направлены на формирование необходимых в современном производстве профессиональных навыков. Для микроскопического исследования полученных частиц используется стандартная методика, освоение которой поможет в ряде других работ. Наряду с [11] работа предлагается для лабораторного практикума в курсе химии в нехимических вузах.
Цель исследования: оптимизация параметров процесса синтеза высокодисперсного карбоната кальция при взаимодействии раствора сахарата кальция и углекислого газа в присутствии ПАВ при повышенном давлении и апробация методики контроля размера получающихся частиц в условиях студенческого практикума по химии.
Материалы и методы исследования
Синтез высокодисперсного CaCO3 производили в соответствии с патентом РФ № 2489355 [12] как при атмосферном, так и при повышенном давлении углекислого газа. При проведении работы использовали одинаковые установки по одной на трёх учащихся, состоящие из высокопрочной прозрачной пластиковой емкости объемом 1 л и дозирующего устройства с предохранительным клапаном и кнопкой сброса избыточного давления. В емкость помещали 1 л раствора сахарозы (100 г/л) (комнатной температуры или предварительно охлажденный), добавляли необходимое количество гидроксида кальция марки х.ч. (от 5 до 10 г/л), раствор ПАВ от 0,01 % до 0,5 %, считая на массу исходного гидроксида кальция, а в дозирующее устройство вставляли предварительно взвешенный стандартный баллончик с пищевой углекислотой. Одновременно с запуском отсчета времени производили дозирование углекислоты в реакционный раствор вблизи дна реакционного сосуда через пластиковую трубку с рассеивающей насадкой. Время проведения реакции составляло при комнатной температуре не более 60 с. При использовании предварительно охлажденного до 6 °C раствора, время реакции не превышало 6 мин. После этого производили сброс избыточного давления углекислого газа до атмосферного. Как вариант проводили синтез при атмосферном давлении, барботируя углекислоту при открытом клапане сброса избыточного давления не менее 3 мин. Затем установку разбирали, реакционный раствор фильтровали на бумажном фильтре под вакуумом, полученный продукт отмывали на фильтре дистиллированной водой, затем ацетоном и высушивали. Пустой баллончик из-под углекислоты взвешивали на техно-химических весах и рассчитывали массу использованного оксида углерода (IV). Высокодисперсный карбонат кальция взвешивали и рассчитывали выход продукта.
Для микроскопического исследования готовили суспензию CaCO3, используя в качестве дисперсионной среды воду. Навеску синтезированного карбоната перетирали в ступке с небольшим количеством воды, переносили смесь в цилиндр и разбавляли водой для получения ~0,5 %-ной (мас.) суспензии, затем добавляли несколько капель раствора дифосфата натрия для предотвращения агрегации частиц. Одну-две капли суспензии наносили на предметное стекло, накрывали покровным стеклом и определяли размер частиц полученного высокодисперсного карбоната кальция микроскопически на приборе «Микромед-2» с камерой DCM-510 5.0M. Результатом исследования являлись микрофотографии образца. Затем изучали дисперсионный состав, определяя размеры, число и форму частиц по микрофотографиям. Обработку микрофотографий проводили в свободно распространяемой программе Image Tool 3.00, результаты микроскопического дисперсионного анализа оформляли графически в виде гистограмм распределения частиц по размерам. Для контроля дополнительно уточняли размеры частиц на отдельных полях зрения с помощью линейки на матовом стекле или шкалы микрофотографии, определяя максимальную хорду частиц и подсчитывая количество частиц по фракциям не менее шести раз в разных местах препарата.
Результаты исследования и их обсуждение
Сахароза в щелочной среде способна диссоциировать с образованием растворимых сахаратов кальция различного строения. После добавления в раствор сахарозы гидроксида кальция, в результате диссоциации преобладает однозарядный катион гидроксокальция и продукты его взаимодействия с сахарозой, а двухзарядные катионы кальция практически отсутствуют. При относительно высоких концентрациях гидроксида могут присутствовать также частицы Са(OН)2 с хемосорбированной на них сахарозой [13]. Чтобы избежать образования сложных комплексов, соотношение сахароза/кальций во всех опытах не превышало 1. После дозирования углекислоты начинается обменная реакция, приводящая к высвобождению кальция в форме карбоната. Этот процесс протекает значительно более медленно, чем при прямом взаимодействии гидроксида кальция с углекислотой, что позволяет контролировать завершение процесса визуально. При комнатной температуре при барботировании углекислоты под атмосферным давлением процесс завершается примерно через 1,5 мин (рис. 1); при дозировании углекислоты под давлением 800 кПа, процесс занимает около 60 с и завершается образованием карбоната с частицами размером около 2,5 мкм (рис. 2, слева).
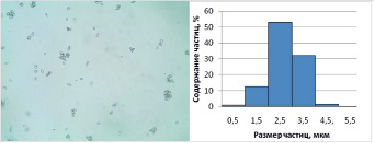
Рис. 1. Микрофотография (микроскоп «Биомед 5» с камерой Livenhuk) и гистограмма распределения частиц CaCO3, полученных в соответствии с патентом РФ № 2489355 барботажем CO2 при атмосферном давлении
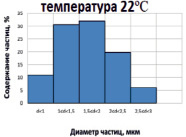
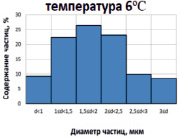
Рис. 2. Гистограммы распределения частиц CaCO3 по размерам, полученных в соответствии с патентом РФ № 2489355 дозированием CO2 при избыточном давлении
Ca(OH)2 + C12H22O11 = C12H20O11Ca + 2 H2O,
C12H20O11Ca + CO2 + H2O = CaCO3↓ + C12H22O11.
У такого относительно медленного протекания реакции нейтрализации, вероятно, обусловленного присутствием сахарозы, есть важное преимущество: появляется возможность плавно регулировать размер частиц продукта пропорционально времени протекания реакции, которое достаточно для гарантированного получения частиц требуемого размера и всё же весьма невелико. Поверхностный заряд частиц полученного карбоната кальция находится в зависимости от pH среды. Так, при значении рН 9,8 образовавшийся осадок СаСО3 имеет слабый положительный заряд и соответственно низкую адсорбционную способность [13], а при рН 9,5 и ниже в растворе накапливается растворимый гидрокарбонат кальция и поверхностный положительный заряд частиц карбоната кальция увеличивается. Этот эффект влияет на агрегативную устойчивость получаемого карбоната кальция и может быть использован для ускорения седиментации частиц. Далее осветленный раствор отделяют декантацией, например, с использованием резиновой трубки с надетой на неё воронкой. Это существенно сокращает объем раствора для фильтрования и ускоряет проведение экспериментальной части работы.
На рис. 2 приведены результаты исследования образцов, полученных в одинаковых условиях, за исключением температуры. Видно, что положения максимума распределения частиц по размерам не меняются. В то же время при пониженной температуре распределение частиц по размерам становится более пологим.
Появляется небольшое количество частиц размером более 3 мкм. Нарушение симметрии формы распределения частиц по размерам при 22 °С в области значений от 1 до 1,5 мкм вызвано, вероятно, образованием дополнительного количества частиц карбоната кальция такого размера в результате разложения гидрокарбоната кальция после резкого сброса избыточного давления оксида углерода (IV). Подобный эффект для гистограммы, полученной при 6 °С, отсутствует, так как растворимость углекислоты при снижении температуры от 22 до 6 °С возрастает практически вдвое.
Используя данные о времени протекания процесса при этих двух различных температурах, можно оценить значение энергии активации процесса. Для этого необходимо маркером нанести на обратную сторону прозрачного реактора близко расположенные штрихи и проводить процесс до момента помутнения реакционной смеси, когда штрихи становятся неразличимыми вначале при одной, а затем при другой температуре. Значение энергии активации должно составить примерно 59 кДж/моль.
Для получения целевого продукта с размером частиц менее 1 мкм можно сократить время реакции. Удобнее сделать это при пониженной до 6 °С температуре. Время протекания реакции при этих условиях составляет около 6 мин, при этом зависимость размера частиц от времени синтеза становится существенно более пологой и воспроизводимость распределения частиц и наивероятнейшего размера от опыта к опыту повышается.
На рис. 3 приведена гистограмма распределения частиц по размерам для имеющегося в продаже импортного высокодисперсного карбоната кальция, полученного обменной реакцией в растворе между хлоридом кальция и карбонатом натрия. Процесс в этом случае протекает значительно быстрее и не осложнен взаимодействием с сахарозой. Это отражается на форме распределения, которое имеет более ярко выраженный максимум, чем на рис. 1 или 2.
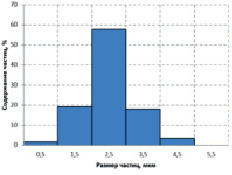
Рис. 3. Гистограммы распределения частиц CaCO3 по размерам в образце импортного высокодисперсного карбоната кальция
Выводы
Было апробировано использование способа получения высокодисперного карбоната кальция по патенту РФ № 2489355 для целей изучения основных закономерностей синтеза высокодисперсных частиц в лабораторном практикуме по химии для студентов вузов. В зависимости от числа часов, предусмотренных на лабораторный практикум, работу можно проводить в двух вариантах. Стандартная методика включает получение высокодисперсного карбоната кальция с размером частиц 2,5 ± 1,0 мкм при комнатной температуре. Продолжительность синтеза составляет около 60 с и определяется визуально как помутнение раствора, при котором не видна нанесенная на противоположную сторону реактора метка. Во втором варианте дополнительно проводят два опыта при пониженной температуре до аналогичного помутнения раствора, исследуя зависимость продолжительности процесса от температуры или варьируют соотношение гидроксида кальция и оксида углерода (IV), изучая влияние избытка соответствующего реагента на агрегативную устойчивость продукта. При наличии микроскопа хорошего качества дополнительно изучают влияние продолжительности синтеза на размер частиц карбоната кальция при пониженной температуре, исследуя три пробы. Например, при 6 °C пробы отбирают через 2 и 4 мин, а завершают синтез при максимальном помутнении реакционной смеси через 6 мин. В первом образце максимум распределения должен находиться вблизи 0,9 мкм; во втором около 1,3 мкм, в третьем – 1,7 мкм.
В работе использованы доступные и недорогие реагенты: гидроксид кальция и пищевой углекислый газ, расфасованный в стандартные баллончики для сифонов. Гидроксид кальция относится к малоопасным веществам (класс опасности) и используется в виде заранее приготовленного раствора низкой концентрации, содержащего сахарозу для лучшего растворения гидроксида (патент РФ № 2489355). Пищевая углекислота и сахароза абсолютно безвредны для здоровья. Отмывку продукта на вакуумном фильтре производят дистиллированной водой и лишь на финальной стадии для ускорения сушки карбоната кальция используют около 2 мл ацетона. Все это позволяет проводить работу в химической лаборатории на лабораторных столах одновременно всем учащимся группы.
Благодаря простоте аппаратурного оформления работа доступна в массовом химическом практикуме. Освоение работы поможет сформировать способность и выработать навыки осуществления технологического процесса синтеза высокодисперсных материалов в соответствии с регламентом; научиться применять микроскопические исследования для измерения основных параметров технологического процесса и продукции при синтезе высокодисперсных материалов; создавать гистограммы в среде Excel и анализировать вид распределения частиц по размерам; выработать умение использовать теоретические знания для оптимизации основных параметров гетерогенных технологических процессов.



