Цель данной работы заключалась в выборе электролита, эффективно разрушающего коллоидный раствор и позволяющего в рамках студенческой лабораторной работы выяснить, как зависит скорость разрушения коллоидного раствора от концентрации и зарядов ионов электролитов.
Для выполнения данной работы потребовались: 10 %-й коллоидный раствор гидроксида железа (III), 2 электролита различных концентраций (раствор сульфата натрия с концентрациями 0,01 моль/л; 0,02 моль/л; 0,03 моль/л; раствор ортофосфата натрия с такими же концентрациями).
Метод определения скорости разрушения коллоида заключался в измерении оптической плотности смеси коллоида с электролитом. Оптическая плотность измерялась с помощью фотометра марки КФК-3. Определение основано на свойстве окрашенных растворов поглощать проходящий через них свет тем сильнее, чем выше в них концентрация окрашивающего вещества. Измерение оптической плотности стандартного и исследуемого окрашенных растворов всегда производят по отношению к раствору сравнения (нулевому раствору). В качестве раствора сравнения использовалась дистиллированная вода.
В одну кювету была налита вода, в другую – 10 мл раствора гидрозоля железа, кюветы были помещены в фотометр. Далее 4 мл раствора электролита сульфата натрия концентрацией 0,01 моль/л приливалось к раствору гидрозоля железа, засекалось время. То же самое повторялось с растворами других электролитов.
Ниже представлены графики зависимости изменения оптической плотности D от времени t. Подъем до максимального значения на графике означает, что начался процесс коагуляции; участок на графике, соответствующий максимальному значению, говорит о том, что в это время образовалось наибольшее количество коллоидных частиц; спад указывает на то, что частицы начали оседать, и раствор постепенно становится прозрачным.
Из рисунка 1 видно, как меняется скорость разрушения с увеличением концентрации электролита. При концентрации 0,03 моль/л разрушение произошло на 3-й минуте, а при 0,01 и 0,02 – на 4-ой. Кроме того, с увеличением концентрации график становится более «острым».
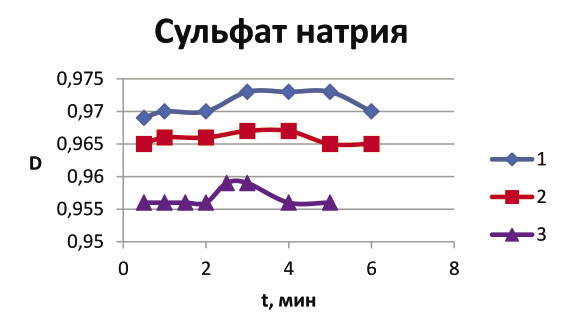
Рис.1 Зависимость оптической плотности D от времени t при использовании сульфата натрия Na2SO4 (1 –концентрация 0,01 моль/л; 2 – 0,02 моль/л; 3 – 0,03 моль/л).
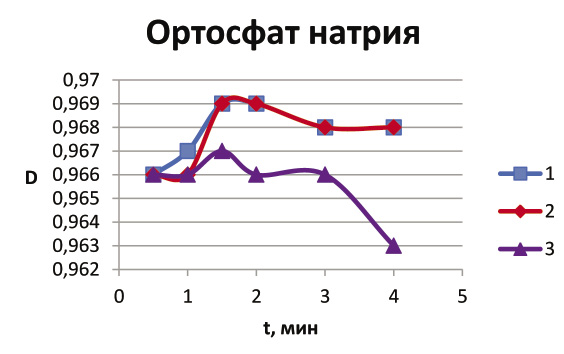 Рис. 2 Зависимость оптической плотности D от времени t при использовании ортофосфата натрия Na3PO4 (1 – концентрация 0,01 моль/л; 2 – 0,02 моль/л; 3 – 0,03 моль/л).
Рис. 2 Зависимость оптической плотности D от времени t при использовании ортофосфата натрия Na3PO4 (1 – концентрация 0,01 моль/л; 2 – 0,02 моль/л; 3 – 0,03 моль/л).
Из сравнения рис. 1 и рис. 2 видно, что в случае использования Na3PO4 коагуляция произошла быстрее, коллоид начал разрушаться после первой минуты. Хорошо видна закономерность: чем выше концентрация электролита, тем эффективнее происходит разрушение коллоида. Но разрушение идет так быстро, что без использования фотоколориметра невозможно увидеть различие в действии Na3PO4 различной концентрации.
В рамках лабораторной работы без использования фотоколориметра при изучении влияния концентрации электролитов на скорость разрушения коллоидного раствора предпочтительнее было бы использовать сульфат натрия, поскольку коагуляция с ним происходит более наглядно, чем с ортофосфатом натрия.
Библиографическая ссылка
Сметанина Е.В., Иванова Т.А. РАЗРУШЕНИЕ КОЛЛОИДНЫХ РАСТВОРОВ // Современные наукоемкие технологии. 2014. № 7-2. С. 80-80;URL: https://top-technologies.ru/ru/article/view?id=34319 (дата обращения: 05.09.2025).



