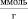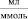В последние годы стали уделять большое внимание вопросам загрязнения окружающей среды отходами производства [1]. Интенсивный рост промышленности приводит к увеличению и отходов производств, которые требуют их переработки. В отходы попадают и ценные компоненты, являющиеся сырьем в различных технологиях [2]. Как правило, природные и производственные воды содержат тяжелые металлы, обладающие высокой токсичностью [3]. Эффективно решить такую проблему возможно с использованием сорбционных технологий [4–6]. Наиболее широкое применение в качестве адсорбентов нашли природные глины. Глины в зависимости от химического состава оксидов металлов обладают разной сорбционной способностью, поэтому важно исследовать их сорбционную способность. Для решения технологических задач по извлечению, концентрированию редких и цветных металлов необходимы сведения по термодинамике.
Исследование адсорбции ионов тяжелых металлов, термодинамические расчеты позволяют определить максимальную рабочую емкость адсорбентов и механизм взаимодействия ионов металлов с адсорбентом.
Поиск новых недорогих сорбентов с высокой сорбционной способностью и разработка сорбционной технологии по извлечению ионов тяжелых металлов из водных систем ведется Тюменским индустриальным университетом [7–9].
Данная работа посвящена оценке адсорбционных и термодинамических свойств каолина по отношению к ионам кадмия, необходимых для проектирования сорбционных установок.
Выбор данного металла связан с его высокой токсичностью. Растворимые соединения кадмия в воде оказывают раздражающее действие на кожу, а при попадании внутрь организма могут вызывать отравление. Кроме этого токсичность кадмия объясняется его сродством с молекулами нуклеиновых кислот. При его присоединения к молекулам ДНК происходит нарушение их функциональности [10]. Извлечение ионов кадмия из природных вод является актуальной задачей.
Материалы и методы исследования
В качестве адсорбента был использован природный каолин. Сканирующим электронным микроскопическим методом был установлен количественный состав основных оксидов, входящих в состав каолина, приведенный в табл. 1.
Таблица 1
Содержание оксидов в составе каолина
|
Содержание |
SiO2 |
Al2O3 |
Na2O |
K2O |
CaO |
Fe2O3 |
TiO2 |
Cd |
|
Состав каолина до сорбции |
||||||||
|
% мас. |
49,22 |
46,87 |
0,13 |
0,42 |
0,86 |
1,21 |
0,97 |
– |
|
Число молей |
0,82 |
0,46 |
0,002 |
0,0045 |
0,015 |
0,0076 |
0,012 |
|
|
Состав каолина после сорбции |
||||||||
|
% мас. |
48,44 |
45,81 |
0,10 |
0,37 |
0,66 |
1,12 |
0,94 |
0,94 |
|
Число молей |
0,81 |
0,45 |
0,0016 |
0,004 |
0,012 |
0,007 |
0,012 |
0,008 |
Таким образом, по содержанию оксида алюминия, согласно ГОСТ 9169-75, глина относится к высокоосновным. Фазовый состав представлен свободным кварцем, каолинитом (96 %), гидрослюдами (2 %).
Для изучения адсорбционных и термодинамических характеристик на каолине использовали модельные растворы нитрата кадмия. Эксперимент проводили при температурах 25, 45, 60 °С. Используя метод переменных концентраций, в статических условиях получали изотермы сорбции. Навеску каолина 1 г заливали 50 мл растворами нитрата кадмия концентрациями от 0,02 до 0,15 ммоль/мл. После установления равновесия (7 суток) определяли остаточное содержание Cd2+ комплексонометрическим титрованием по методике [11].
Статическую адсорбционную емкость каолина вычисляли по формуле
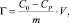 (1)
(1)
где С0 и СР – исходная и равновесная концентрации ионов кадмия в растворе, моль/мл; m – навеска каолина, г; V – объем раствора, мл.
Результаты исследования и их обсуждение
Для расчета термодинамических параметров адсорбции ионов Cd2+ были получены изотермы сорбции (рис. 1). Проанализировав полученные экспериментальные данные, можно сделать вывод, что адсорбционная емкость поглощения ионов кадмия увеличивается с ростом содержания их в исходном растворе. Влияние концентрации Cd2+ в большей степени влияет в области низких значений, где величина адсорбции прямо пропорциональна концентрации Cd2+. Затем идет постепенное насыщение поверхности адсорбента.
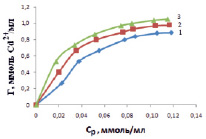
Рис. 1. Изотермы сорбции ионов Cd2+ на каолине при температурах, С: 25 °, 45 °, 60 °
Для объяснения экспериментальных данных использовали уравнения изотерм Ленгмюра (2), Фрейндлиха (3), Темкина (4) в линейной форме (рис. 2):
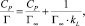 (2)
(2)
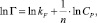 (3)
(3)
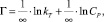 (4)
(4)
где Г∞ – предельная адсорбция монослоя (ммоль/г), CP – равновесная концентрация ионов металла (ммоль/мл), kL – концентрационная константа адсорбционного равновесия, мл/ммоль; kF и n – константы Фрейндлиха; kT и ∞ – константы Темкина.
Линейная обработка изотерм адсорбции ионов кадмия из водных растворов на каолине представлена в табл. 2.
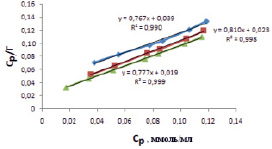
Рис. 2. Изотермы адсорбции ионов кадмия по линейному уравнению Ленгмюра
Таблица 2
Обработка изотерм адсорбции ионов кадмия по моделям
|
Т, К |
Ленгмюра |
Фрейндлиха |
Темкина |
||||||
|
Г∞,
|
kL,
|
R2 |
lnkF |
1/n |
R2 |
lnkT |
1/α |
R2 |
|
|
298 |
1,21 |
19,66 |
0,990 |
1,481 |
0,691 |
0,914 |
4,62 |
0,375 |
0,978 |
|
318 |
1,25 |
34,82 |
0,998 |
1,107 |
0,485 |
0,922 |
5,89 |
0,325 |
0,972 |
|
333 |
1,29 |
40,84 |
0,999 |
0,881 |
0,361 |
0,973 |
6,00 |
0,281 |
0,992 |
Значения коэффициентов корреляции показывают, что модель Ленгмюра описывает экспериментальные данные лучше, чем модель Фрейндлиха и модель Темкина. На рис. 2 показано, что экспериментальные данные хорошо укладываются на прямых линиях. Графическим методом были определены значения Г∞ и kL. Результаты расчета подтверждают, что предельная адсорбция Г∞ ионов кадмия на каолине составляет 1,21 ммоль/г. Константа адсорбционного равновесия kL имеет значение 19,66 мл/ммоль (298 К).
Определив экспериментально емкость монослоя Г∞, можем рассчитать удельную поверхность адсорбента по уравнению
Sуд = Г∞?NА?S0, (5)
где S0 – площадь, занимаемая одним адсорбированным ионом, м2; NА – число Авогадро, ммоль-1.
Для расчета удельной поверхности использовали значение гидратированного радиуса иона кадмия, равного 4,26 А. Удельная поверхность для каолина составляет 408 м2/г.
Различные значения величины адсорбции при изменении температуры позволяют определить значения термодинамических характеристик адсорбции: энтальпии (ΔН), энтропии (ΔS) и энергии Гиббса (ΔG).
Для расчета ΔН использовали в интегральном виде уравнения изостеры. Метод расчета теплоты адсорбции основан на применении уравнения Клаузиуса – Клапейрона [12].
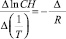 при Г = const, (6)
при Г = const, (6)
где С – равновесная концентрация, ммоль/мл; Т – температура, К; ?Н – изостерическая дифференциальная теплота адсорбции, Дж/моль; R – универсальная газовая постоянная, Дж/моль·К.
На рис. 3 представлены изостеры адсорбции ионов Cd2+ на каолине. По углу наклона изостер определили тепловой эффект процесса адсорбции.
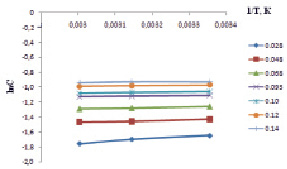
Рис. 3. Изостеры адсорбции ионов Cd2+ на природном адсорбенте каолине
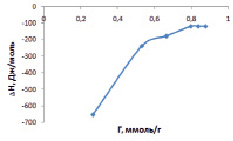
Рис. 4. Изменение энтальпии адсорбции ионов Cd2+ от величины сорбции на каолине
Результаты расчета приведены на рис. 4, они показывают, что с увеличением величины адсорбции ионов кадмия на каолине начинает возрастать ΔН.
В области малых концентраций ионы кадмия адсорбируются на самых активных местах поверхности каолина, что сопровождается увеличением энтальпии. По мере заполнения активных центров остаются менее активные центры, заполнение которых сопровождается уменьшением энтальпии.
Энергию Гиббса ΔG и ΔН определяли в соответствии с уравнениями [13]:
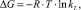 (7)
(7)
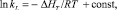 (8)
(8)
где ΔG – энергия Гиббса, Дж/моль; R – молярная газовая постоянная, Дж/моль·К; Т – температура, К; kL – константа равновесия. По рассчитанным значениям ΔG и ΔH определили значения ΔS из уравнения
?G = ?H – T?S. (9)
Результаты расчета термодинамических параметров адсорбции приведены в табл. 3.
Таблица 3
Термодинамические параметры адсорбции кадмия на каолине
|
Температура, К |
Г∞, ммоль/г |
?G, кДж/моль |
?H, кДж/моль |
T?S, Дж/моль·К |
|
298 |
1,21 |
–7,38 |
–0,65 |
6,73 |
|
318 |
1,25 |
–9,38 |
8,73 |
|
|
333 |
1,29 |
–10,27 |
9,62 |
На основе анализа полученных значений термодинамических параметров можно констатировать, что для всех изотерм адсорбции ?H имеет отрицательные значения, характерные для экзотермического процесса.
Величина значения ΔН подтверждает физическую адсорбцию ионов кадмия на природном каолине. В первую очередь на самых активных местах поверхности каолина, характеризующихся наибольшей величиной адсорбционного поля, адсорбируются ионы кадмия. После заполнения самых активных мест адсорбционной поверхности, происходит заполнение менее активных центров, а также начинает проявляться полислойная адсорбция за счет образования связи «металл – металл» [14]. Это приводит к снижению теплового эффекта адсорбции.
Литературные данные [15] по отрицательным значениям T?S при адсорбции на твердых адсорбентах, характеризуют процесс упорядочения ионов адсорбтива на поверхности адсорбента. В свою очередь, глинистые минералы представляют собой коллоидные системы со слоистой структурой, в таких системах значения T?S > 0.
Значения энергии Гиббса (ΔG) свидетельствуют, что процесс адсорбции протекает за счет устойчивого закрепления ионов кадмия на поверхности каолина и характеризует самопроизвольное протекание адсорбции ионов [15].
Заключение
Таким образом, значения коэффициентов корреляции подтверждают, что модель Ленгмюра описывает экспериментальные данные лучше, чем модель Фрейндлиха и модель Темкина, что свидетельствует об образовании мономолекулярного сорбционного слоя при адсорбции.
Термодинамические параметры, полученные в ходе исследования, важны при использовании сорбционной технологии очистки водных систем от ионов кадмия с использованием природного каолина.