Перспективным направлением применения природных глинистых минералов является адсорбция и концентрирование ионов цветных металлов из водных растворов различной природы. В природе гетерогенных систем широко распространено межфазное распределение ионов металлов. Природные воды в настоящее время загрязняются промышленными стоками, что создает серьезную проблему и ухудшает экологическую обстановку. Основной вклад в загрязнение вносят гальванические и травильные производства. Эти производства требуют большого количества воды [4] для промывки обрабатываемых деталей, в результате чего происходит сброс большого количества отходов [5].
В связи с этим ведется поиск эффективных природныхсорбентов для извлечения цветных и тяжелых металлов из сточных вод. Каолинит как природный минерал известен давно [1], является главным составляющим всех глин. Основа – это водные алюмосиликаты Al4[Si4O10][OH]8 с небольшими примесями железа (III), магния, кальция, натрия, калия.
Целью настоящей работы являются результаты исследований структуры и адсорбционных свойств природного каолинита, который может быть применен для очистки сточных вод от ионов марганца.
Материалы и методы исследования
Природный сорбент каолинит представляет собой легкий порошок белого цвета с размерами частиц 2–20 мкм и насыпной плотностью 0,3 г/см3. На рис. 1 представлена СЭМ-микрофотография образца сорбента, полученная на сканирующем электронном микроскопе. По полученным данным, основными его компонентами являются оксиды в количествах, представленных в табл. 1.
Атомное отношение алюминия к кремнию, по представленным данным составляет ~1/2,4, что соответствует максимальному числу и силе кислотных центров поверхности алюмосиликатного каркаса каолинитовой глины [7]. Активными центрами являются подвижные ионы Na+ и К+, принимающие участие в обмене на ионы тяжелых металлов.

Рис. 1. СЭМ-микрофотография каолинита
Таблица 1
Содержание компонентов в составе каолинита
|
Содержание |
SiO2 |
Al2O3 |
Na2O |
K2O |
CaO |
Fe2O3 |
|
% масс. |
43,98 |
18,73 |
0,96 |
0,80 |
0,06 |
6,32 |
|
Число молей |
0,732 |
0,180 |
0,015 |
0,007 |
0,009 |
0,057 |
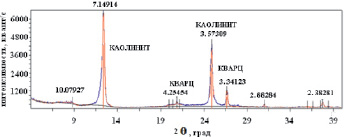
Рис. 2. Рентгенограмма образца каолинита
Минералогический состав каолинита определяли рентгенофазовым анализом. На рис. 2 представлена рентгенограмма, снятая на дифрактометре «ДРОН-7» с медным анодом (λ = 1,5406 A).
Результаты рентгенофазового анализа дают дополнительные основания для предположения о высокой подвижности и обменной способности катионов Na+ и К+, удерживаемых на поверхности каолинита.
Для изучения сорбции ионов марганца (II) на каолините изучали в статических условиях из нитратных растворов с концентрациями от 0,01 до 0,24 ммоль/мл. Сорбент в солевой форме (обработанный раствором NaCl) в количестве 1 г заливали 50 мл раствора. Контакт сорбента с раствором продолжался до установления равновесия в течение 7 суток. Затем сорбент и раствор отделяли и анализировали на содержания ионов марганца и измеряли рН среды. Концентрацию ионов марганца в растворе определяли комплексонометрическим титрованием с трилоном Б в присутствии индикатора эриохрома черного [9].
Результаты исследования и их обсуждение
На основании полученных данных рассчитали статическую емкость природного каолинита в солевой форме по марганцу (II) (моль/г):
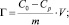
коэффициент распределения Kd, мл/г
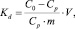 мл/г,
мл/г,
где С0 – концентрация марганца в исходном растворе, ммоль/мл; Ср – равновесная (остаточная) концентрация извлекаемого иона в растворе, ммоль/мл; V – объем раствора, мл; m – масса сорбента, г. Результаты расчетов представлены в табл. 2.
Таблица 2
Коэффициент распределения, степень сорбции и статическая обменная емкость каолинита при извлечении марганца (II) из растворов при температуре 298 К
|
С0, ммоль/мл |
0,0188 |
0,0413 |
0,0738 |
0,0938 |
0,119 |
0,145 |
|
Ср, ммоль/мл |
0,0185 |
0,0409 |
0,0734 |
0,0933 |
0,118 |
0,144 |
|
Kd, мл/г |
0,676 |
0,382 |
0,256 |
0,234 |
0,216 |
0,189 |
|
Г, ммоль/г |
0,0125 |
0,0156 |
0,0188 |
0,0219 |
0,0313 |
0,0313 |
Модифицированный каолинит, обработанный раствором NaCl, изменяет свои физико-химические свойства. При переводе природной формы каолинита в солевую форму происходит значительное увеличение положительного заряда поверхности. Последующие эксперименты показали, что выявленные изменения физико-химических свойств каолинита позволяют резко увеличить эффективность адсорбции ионов марганца на поверхности. На рис. 3 видно, что количество поглощенных ионов марганца закономерно увеличивается с ростом концентрации в исходном растворе.
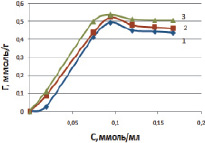
Рис. 3. Зависимость величины адсорбции ионов марганца от исходной концентрации на модифицированной солевой форме каолинита при температурах, К: 298 (1); 313 (2); 333 (3)
На изотермах сорбции, приведенных на рис. 4, виден резкий подъем в области малых равновесных концентраций марганца, что подтверждает увеличение количества поглощенных ионов с ростом их в исходном растворе. На этом отрезке наблюдается линейная зависимость количества поглощенных ионов марганца от равновесной концентрации в растворе (отрезок Генри). Затем изотерма выходит на плато, что характерно для монослойного закрепления ионов марганца на поверхности каолинита.
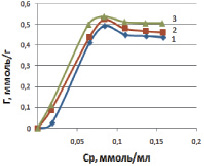
Рис. 4. Изотермы адсорбции ионов марганца на каолините в солевой форме (Na) при температурах, К: 298 (1), 313 (2), 333 (3)
Для описания адсорбционного процесса было использовано несколько моделей Ленгмюра:
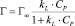
или
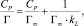
где Г – количество сорбированного марганца; Г∞ – величина предельной сорбции (ммоль/г); CP – равновесная концентрация ионов меди в растворе (ммоль/мл); kL – концентрационная константа сорбционного равновесия, характеризующая интенсивность процесса сорбции, мл/ммоль.
Модель изотермы Ленгмюра основана на том, что на поверхности катионита образуется мономолекулярный сорбционный слой и все активные места обладают равной энергией и энтальпией сорбции.
Фрейндлиха:
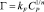
или в логарифмической форме:
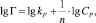
где kF и n – константы Фрейндлиха.
Модель Фрейндлиха используется для описания сорбции на гетерогенной поверхности. Относительную адсорбционную способность отражает константа kF, а интенсивность сорбционного процесса и распределение активных центров характеризует константа n.
Темкина:
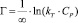
или
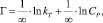
где kT и ∞ – константы Темкина.
Модель Темкина содержит параметр kT, который учитывает взаимодействие между адсорбционными центрами и ионами металлов. Кроме того, данная модель предполагает, что теплота адсорбции молекул в слое линейно уменьшается по мере заполнения слоя из-за отталкивания ионов металла. Снижение теплоты адсорбции происходит по линейному закону.
Линейная обработка изотерм сорбции ионов марганца из водных растворов на Na+ – форме каолинита представлены в табл. 3.
Таблица 3
Обработка изотерм сорбции ионов марганца (II) по моделям
|
Температура, К |
I ступень |
II ступень |
||||
|
Г∞, ммоль/г |
K, г/ммоль |
R2 |
Г∞, ммоль/г |
K, г/ммоль |
R2 |
|
|
Ленгмюра |
||||||
|
298 |
0,3 |
40,5 |
0,975 |
0,3 |
32,0 |
0,998 |
|
313 |
0,4 |
102,2 |
0,988 |
0,6 |
16,0 |
0,999 |
|
333 |
0,8 |
123,3 |
0,988 |
0,8 |
13,3 |
0,999 |
|
Фрейндлиха |
||||||
|
lgkF |
1/n |
R2 |
lgkF |
1/n |
R2 |
|
|
298 |
1,4 |
0,28 |
0,998 |
0,12 |
1,5 |
0,999 |
|
313 |
0,89 |
0,44 |
0,999 |
0,26 |
1,3 |
0,998 |
|
333 |
0,66 |
0,55 |
0,974 |
0,38 |
0,8 |
0,999 |
|
Темкина |
||||||
|
lgkT |
1/n |
R2 |
lgkT |
1/n |
R2 |
|
|
298 |
0,034 |
0,013 |
0,950 |
0,118 |
0,094 |
0,999 |
|
313 |
0,025 |
0,020 |
0,999 |
0,473 |
0,324 |
0,999 |
|
333 |
0,010 |
0,021 |
0,999 |
0,665 |
0,503 |
0,999 |
Результаты табл. 3 показывают, что при сорбции ионов марганца на солевой форме каолинита предельная адсорбция Г∞ равна 1,6 ммоль/г, а константа адсорбционного равновесия К, равная 40,5 мл/ммоль (298 К), характеризует энергию взаимодействия ионов марганца с поверхностью сорбента.
Значение константы n в уравнении Фрейндлиха (n > 1) свидетельствует о благоприятных условиях адсорбции ионов марганца по первой ступени, энергия связи между сорбентом и ионами марганца уменьшается по мере заполнения поверхности. На первой ступени сорбции не достигается ее предельное значение. Сорбция происходит одновременно на различных активных центрах. На второй ступени сорбция протекает на менее доступных активных центрах.
Значения второй константы Фрейндлиха kF указывают на легкость перехода ионов марганца из раствора в фазу сорбента и на сорбционную способность по отношению к ионам марганца.
Коэффициент kT в модели Темкина учитывает взаимодействия между адсорбционными центрами и ионами марганца.
На основании результатов рентгенофазового анализа можно предположить, что мономолекулярная адсорбция ионов марганца протекает по механизму эквивалентного обмена внекаркасных ионов Na+ и K+.
Изменение температуры процесса сорбции ведет к изменению термодинамических параметров. Полученные экспериментальные данные позволили рассчитать свободную энергию Гиббса кДж/моль по формуле
ΔG =–R•T•lnK,
где R – универсальная газовая постоянная, равная 8,314 Дж/моль•К; Т – температура, К; К – константа адсорбционного равновесия.
Величина ΔG свидетельствует о спонтанном протекании процесса сорбции. Полученные значения энергии Гиббса имеют отрицательный знак –3,98 (298 К); –5,23 (313 К); –5,81 (333 К) (кДж/моль), что соответствует устойчивому закреплению на поверхности каолинита. Кроме этого, отрицательные значения энергии Гиббса характеризуют самопроизвольное протекание сорбции ионов марганца на каолините.
Заключение
На основании приведенных исследований и полученных результатов можно сделать следующие выводы:
Изотермы сорбции ионов марганца на каолините обработаны моделями изотерм сорбции Ленгмюра, Фрейндлиха, Темкина.
Установлено, что сорбция ионов марганца из разбавленных растворов лучше описывается моделью Ленгмюра, что подтверждает образование мономолекулярного слоя.
Определены значения предельной статической сорбционной емкости каолинита, которая составляет 1,6 ммоль/г, вычислены коэффициенты распределения, значения которых уменьшаются с увеличением концентрации ионов марганца в растворе.
Рассчитаны значения энергии Гиббса –3,98 (298 К); –5,23 (313 К); –5,81 (333 К) кДж/моль.



