Загрязнение водной среды ионами тяжелых металлов опасно для всей биосферы, а также свидетельствует о расточительном отношении к ресурсам. Со сточными водами гальванотехники теряется более 50 % металлов, предназначенных для декоративных, защитных и других покрытий. Кроме того тяжелые металлы оказывают токсичное воздействие на живые и растительные организмы, имеют тенденцию к накапливанию в пищевых цепочках, что усиливает их опасность для человека. Наиболее опасны ионные комплексные формы тяжелых металлов. Медь, марганец, кобальт, никель, цинк, кадмий, железо, хром относятся к группе токсичных тяжелых металлов. Это вызывает необходимость строгого контроля за их поступлением в окружающую среду, что требует на практике использования сравнительно недорогих, доступных методов их улавливания.
Промышленные сточные воды многих химических, текстильных, машиностроительных, электротехнических заводов, предприятий цветной металлургии и других отраслей промышленности в большей или меньшей степени загрязнены солями цветных и тяжелых металлов. Наиболее часто они загрязнены солями цинка, кадмия, меди, хрома, никеля, ртути, железа реже содержат кобальт, марганец. В сточных водах практически никогда не содержится только один вид катионов, а содержится смесь нескольких солей минеральных кислот. Чаще всего наряду с солью цветного металла содержатся соли железа, а также соляная кислота.
С каждым годом расширяется сфера использования редких металлов – это радиоэлектроника, металлургия, авиация, химическая промышленность. Высокая стоимость, сложность переработки редких металлов привели к необходимости получения тонких металлических пленок на поверхности деталей. Для этой цели в настоящее время в гальванической технике используются такие редкие металлы как индий, молибден, германий, галлий и таллий. Промывные воды, как правило, содержат достаточное количество этих элементов, что требует разработки новых способов их извлечения. Появилась необходимость решения ряда технических, экономических и экологических проблем.
Эффективность и экономичность извлечения ионов цветных, тяжелых и редких металлов из сточных вод методом ионного обмена зависит от их концентрации в воде, рН, общей минерализации воды.
Гальваническое производство относится к разряду весьма опасных источников загрязнения окружающей среды. Существует необходимость, рассматривать варианты бессточных систем водоиспользования с максимально возможным сокращением расхода свежей воды на промывку деталей.
Ионообменная очистка сточных вод от ионов металлов получает все большее распространение. С экономической точки зрения наиболее целесообразна ионообменная очистка не общего стока гальванического производства, а сточных вод, образующихся в отдельных технологических процессах и операциях и содержащих как можно меньше количества металлов и кислот. В этом случае переработка и возврат в производство концентрированных растворов, образующихся при регенерации ионитов и содержащих различные химические продукты, вызывает наименьшие трудности.
Ионообменные методы регенерации позволяют не только полностью извлекать цветные, тяжелые и редкие металлы из отработанных растворов, но также получать продукты регенерации в виде чистых солей металлов, пригодных для повторного использования в производстве с целью приготовления заново и корректировки работающих электролитов. Кроме того, получаемая после ионообменной обработки очищенная вода в большинстве случаев без дополнительной обработки может быть использована в качестве оборотной. Таким образом, использование ионообменных методов с целью регенерации металлов позволяет достичь практически безотходной технологии в гальванических производствах.
При обратимости ионного обмена процессы сорбции и десорбции являются взаимосвязанными. Условия, влияющие на процесс сорбции, оказывают влияние и на процесс десорбции, то есть определяют легкость и полноту десорбции ионов из катионита раствором того или иного электролита, расход и степень использования регенерирующего раствора. Скорость и полнота вымывания определяется не только свойствами сорбированного иона (заряд, размер, степень гидратации, способность образовывать комплексные ионы), но и свойствами иона соли или кислоты элюента, его ионообменным сродством к иониту данного типа, его концентраций.
В настоящей работе при исследовании процесса десорбции ионов металлов из фосфорнокислого катионита КФП-12 использованы растворы HCL, H2SO4, NH4Cl, (NH4)2SO4. Процесс вымывания катионов металлов зависит от типа электролита, способности его вступать в реакции комплексообразования с сорбированными катионами, рН среды и концентрацией ионов металла в элюате.
В водных растворах соляная и серная кислоты ведут себя как сильные электролиты, степень диссоциации 0,1 растворов соответственно равны 0,9 и 0,6. Серная кислота представляет собой двухосновную кислоту, ступенчатые константы диссоциации при температуре 25 °С (μ = 0) равны K1 = 1∙103 и K2 = 1,2∙10–2 [1]. Диссоциацию серной кислоты выражаются уравнениями:
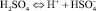
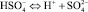
В зависимости от концентрации серной кислоты в растворах изменяется ионный состав [1]. Серная кислота в растворах менее диссоциирована в растворах, по сравнению с соляной кислотой. В таблице приведены данные по свойствам водных растворов соляной, серной кислот и их солей.
Приведенные данные по свойствам водных растворов кислот и солей показывает, что общим для них является вытесняющий катион H+ или 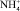 (для солей). В результате разной степени диссоциации данных соединений наблюдается различие концентрации катионов и рН среды. Например, в ряду солей аммония степень диссоциации и, следовательно, концентрация свободных ионов аммония значительно уменьшается в ряду:
(для солей). В результате разной степени диссоциации данных соединений наблюдается различие концентрации катионов и рН среды. Например, в ряду солей аммония степень диссоциации и, следовательно, концентрация свободных ионов аммония значительно уменьшается в ряду:
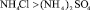
Отмеченные различия существенны и должны оказывать большое влияние на поведение катионов металлов при их вымывании из катионита КФП-12. Для катионов, связанных с функциональными группами катионита ионной связью определяющую роль в элюирующем растворе играет концентрация вытесняющего иона. Слабокислотный катионит КФП-12 обладает высоким сродством к ионам водорода и низкое к ионам аммония. Это обуславливает различие в вымывающей способности растворов минеральных кислот и аммонийных солей по отношению к ионам металлов, если последние не образуют хлоридных или сульфатных комплексов. В противном случае будет сказываться на вымывании прочность комплексных соединений. Например, медь (II), кобальт и никель образуют анионные хлоридные комплексы при концентрациях соляной кислоты соответственно: 4,0; 6,5 и 10–11 моль/дм3. Поведение катионов, связанных с ионогенной группой ионно-координационной связью, будет определяться рН среды и прочностью комплексов, образующихся при взаимодействии катиона металла с элюирующим раствором. В кислой среде возможно разрушение комплекса металла с ионогенной группой.
Коэффициенты активности соляной, серной кислот и их аммонийных солей в водных растворах при 25 °С [2]
|
Электролит |
Коэффициент активности при концентрации электролита, моль/100 г |
|||||
|
0,01 |
0,05 |
0,1 |
0,3 |
0,5 |
1,0 |
|
|
H2SO4 |
0,544 |
0,340 |
0,266 |
0,183 |
0,156 |
0,132 |
|
HCl |
0,905 |
0,831 |
0,796 |
0,777 |
0,789 |
0,871 |
|
(NH4)2SO4 |
– |
– |
0,770 |
0,687 |
0,649 |
0,603 |
|
NH4Cl |
– |
– |
0,423 |
0,300 |
0,248 |
0,183 |
В этом случае катионы металла будут вымываться растворами кислот, но не будет наблюдаться вымывание растворами нейтральных солей. Необходимо добавить, что растворы минеральных кислот не всегда могут быть эффективными десорбентами. Это происходит в тех случаях, когда прочность комплексных соединений металла с ионогенной группой очень велика даже в кислых растворах. В этих случаях десорбирующий раствор должен содержать ион, который может взаимодействовать с сорбированным элементом с образованием более устойчивого комплексного соединения по сравнению с полимерным комплексом. Например, индий десорбируется только растворами соляной кислоты. Эффективность соляной кислоты связана с образованием индием анионных хлоридных комплексов.
Рассмотренные свойства соляной и серной кислот и их солей, как элюентов, с учетом комплексообразующих свойств катионита и способности сорбированных катионов элементов образовывать нейтральные или анионные комплексы, показывают, что различие в поведении катионов металлов на стадии десорбции должны проявляться при использовании растворов хлористого и сернокислого аммония. Способность ионогенных групп к протонированию должна уравнивать поведение катионов, не образующих хлоридные или сульфатные комплексы, при десорбции катионита растворами соляной и серной кислот. Все отмеченное хорошо подтверждается экспериментальными данными.



