Многокомпонентность исходных растворов, подлежащих дезактивации, наличие в них большого количества поливалентных металлов - Fe(III), Al и др. в той или степени должно накладывать свой отпечаток на особенности процесса соосаждения радия с сульфатом бария.
Анализ литературных данных свидетельствует о том, что сведения о дезактивации сложных по составу солевых растворов крайне ограничены и порой противоречивы. Ранее (1980-1990 г.) были проведены исследования [3] по обезвреживанию и дезактивации растворов от "гидроразмыва" отработанного расплава солевого оросительного фильтра (СОФ) процесса хлорирования лопаритовых концентратов, содержащих, г/дм3: 0,36±0,26 Ta; 1,86±0,76 Nb; 0,32±0,17 Ti; 7,81±4,57 Th; 28,76±12,62 РЗЭ; 17,37±6,32 Fe; 19,42±9,94 Al; 10,02±4,35 SiO2; 18,42±7,33 H.O.; хлориды калия, натрия магния, кальция; рНисх 0,9-1,8; удельная активность 90-220 кБк/кг. Эти исследования показали, что введение в исходные растворы хлорида бария и серной кислоты с последующей нейтрализацией до рН 7-8 известковым молоком является малоэффективным, так как остаточная активность фильтратов (от 1 до 10 кБк/кг) в этом случае оказывалась практически такой же, что и в опытах, в которых BaCl2 и H2SO4 не использовали, а осуществляли лишь нейтрализацию исходных растворов известковым молоком. На этом основании нами ранее был сделан вывод о том, что в сложных по составу технологических растворах ионы поливалентных металлов оказывают "блокирующее" влияние на сульфат бария, в связи с чем, сульфат бария в таких растворах, как коллектор для радия "не работает", т.е. соосаждение радия с BaSO4 либо не происходит, либо наблюдается в незначительной степени. Учитывая изложенное, при разработке, испытаниях и последующем промышленном освоении технологии дезактивации растворов СОФ операция обработки исходных растворов хлоридом бария и серной кислотой была исключена и на первой стадии дезактивацию осуществляли лишь обработкой известковым молоком.
С другой стороны, ранее нами было обнаружено [4], что на второй стадии дезактивации, т.е. после отделения осадка суммы оксигидратов металлов, последовательная обработка фильтратов растворами BaCl2, H2SO4, дополнительное смешение с железосодержащими (2-5 г/дм3 FeCl3) цеховыми "обмывочными" водами или с раствором FeCl3 и последующая нейтрализация известковым молоком до рН 7-8, обеспечивают весьма существенное повышение степени дезактивации (по сравнению с обработкой фильтратов только растворами хлорида бария и серной кислоты) - до установленных для цеха норм (менее 6 Бк/кг). Наблюдаемый эффект был объяснен образованием в растворе помимо осадка BaSO4 оксисульфатов железа общей формулой FexSyOz, в частности Fe6S8O33, которые, по-видимому, обладают повышенной сорбционной активностью по отношению к радию [4]. С использованием методов рентгенофазового и рентгеноструктурного анализа было установлено [5], что в оптимальных условиях, обеспечивающих 99,99% степень дезактивации, в растворе образуется оксисульфат железа Fe6S8O33.
Таким образом, ранее выполненные собственные исследования авторов, приводят к довольно противоречивым выводам: с одной стороны, полученные экспериментальные данные косвенно указывали на то, что в присутствии хлоридов поливалентных металлов соосаждение радия с сульфатом бария происходит незначительно (на фоне соосаждения радия с осадками суммы оксигидратов металлов), а, с другой стороны, дополнительное введение в раствор Fe(III) повышает степень соосаждения радия и степень дезактивации солевых растворов в целом.
Тем не менее, несмотря на эти, на первый взгляд трудно объяснимые противоречия, совокупность экспериментальных данных и результатов опытных и промышленных испытаний позволила в 1983-1985 г. разработать и успешно реализовать*) в промышленных условиях технологию, обеспечивающую дезактивацию растворов СОФ до установленных норм (Ауд.< 6 Бк/кг). Данная технология успешно эксплуатируется на полный объем переработки отходов производства более 20 лет. Ее основным недостатком является образование большого количества вторичных РАО, подлежащих захоронению в хранилище спецотходов (ХСО).
Учитывая все изложенное, данная статья посвящена исследованию особенностей дезактивации многокомпонентных растворов, и в частности, изучению влияния ионов Fe3+ и/или Al3+ на соосаждение радия с сульфатом бария из солевых растворов, поиску оптимальных условий дезактивации и разработке на основе совокупности полученных экспериментальных данных новой, усовершенствованной технологии, обеспечивающей одновременное решение двух проблем: дезактивация растворов СОФ до установленных норм и сокращение общей массы образующихся при этом вторичных радиоактивных отходов, подлежащих захоронению.
Экспериментальная часть
В работе были использованы радийсодержащие растворы следующего состава, г/дм3: 0,2-0,5 CaCl2; 75-83 NaCl, а также FeCl3 и/или AlCl3.Удельная активность Ra-226 и Ra-228 50±6 и 2500±180 Бк/кг соответственно; рН = 1,8±0,2
Изучение влияния степени соосаждения радия с сульфатом бария от концентрации ионов Fe3+ и Al3+ в исходном растворе проводилось следующим образом. В исходный радийсодержащий раствор вводили различное количество раствора FeCl3 или AlCl3 из расчета 0-10 г Me3+ на дм3 раствора. С помощью соляной кислоты регулировали значение величины рН растворов. Затем вводили раствор хлорида бария (г/дм3) в количестве 5,5 моль/дм3 и раствор сульфата натрия (г/дм3) при двойном избытке сульфатов-ионов по отношению к барию. Суспензию перемешивали 30 мин и фильтровали. Степень соосаждения радия рассчитывали как отношение количества соосажденного радия к его исходному количеству в растворе:
![]()
где Аисх - активность радионуклидов радия в исходном радийсодержащем растворе, Бк/кг; Аф - активность радионуклидов радия в фильтрате, Бк/кг..
Определение радионуклидов в пробах проводилось методом гамма - спектроскопии на гамма - спектрометре "ПРОГРЕСС - ГАММА" по методике, описанной в работе [4].
Результаты и обсуждение
При изучении влияния многовалентных ионов (Fe3+ и Al3+) предварительно была рассмотрена адсорбция ионов Fe3+ и Al3+ сульфатом бария, при этом исследовалось влияние концентрации указанных компонентов, мольного отношения хлорида бария и сульфата натрия и величины рН на степень поглощения указанных ионов осадком BaSO4. Было установлено, что смена знака заряда потенциалопределяющих ионов частиц сульфата бария, а также изменение величины рН в пределах от 0,8 до 2,1 не оказывают заметного влияния на поглощение ионов Fe3+ и Al3+ осадком BaSO4.
Как видно из рис. ионы 1, Fe3+ и Al3+ достаточно хорошо поглощаются сульфатом бария - с повышением равновесной концентрации железа (III) и алюминия изотерма круто поднимается вверх.
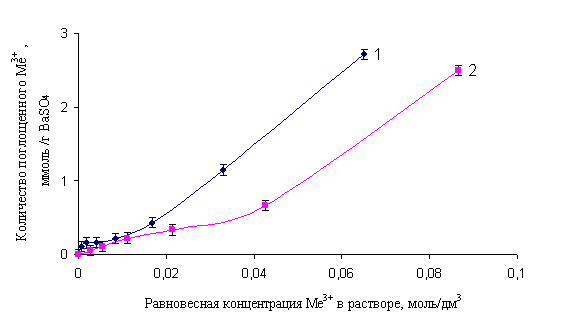
Рис. 1. Изотермы адсорбции Fe3+ (1) и Al3+ (2) сульфатом бария: объем исходных растворов - 0,05 дм3; объем 0,5 M раствора BaCl2 - 1 см3; объем 0,5 М раствора Na2SO4 - 2 см3; время выдержки - 30 мин; рН = 1,8±0,02
Таким образом, если ионы Fe3+ и Al3+ поглощаются осадком BaSO4 по механизму вторичной адсорбции, то, обладая более высоким зарядом, они должны вытеснять ионы радия из адсорбционного и диффузионного слоев частиц сульфата бария и, тем самым, понижать степень соосаждения радия. Действительно, ранее [7] было установлено, что предварительная нейтрализация исходного радиоактивного раствора, содержащего ионы поливалентных металлов и макроколичества Са2+, позволяет существенно повысить степень соосаждения радия с сульфатом бария. Полученный эффект объяснялся тем, что проведение процесса поглощения радия из раствора, содержащего большое количество солей многовалентных металлов (Fe3+, Al3+, РЗЭ и др.) снижает адсорбцию микрокомпонента (Ra2+) вследствие конкуренции одноименно заряженных ионов у поверхности адсорбента. Однако результаты опытов по исследованию влияния ионов Fe3+ и Al3+ на степень соосаждения радия с сульфатом бария приводят к противоположному выводу: присутствие этих макрокомпонентов в радийсодержащем растворе не оказывает существенного влияния на соосаждение радия с сульфатом бария, а с увеличением концентрации ионов алюминия наблюдается даже некоторый рост степени соосаждения радия с сульфатом бария (рис. 2).
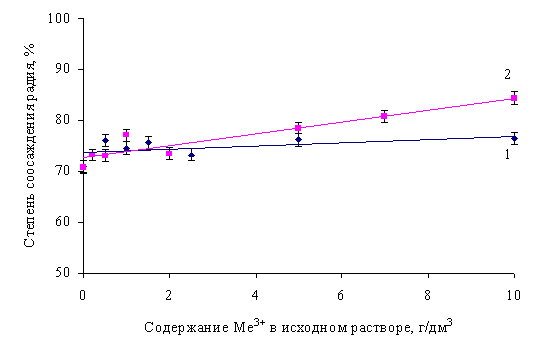
Рис. 2. Соосаждение радия с сульфатом бария в присутствии ионов Fe 3+ (1) и Al 3+ (2):
1 - рН = 1,0±0,02; 2 - рН = 1,5±0,02.
Таким образом, можно сделать вывод о том, что вопреки устоявшемуся мнению, ионы Fe3+ и Al3+ не проявляют конкурирующего действия у поверхности сульфата бария. Полученное можно объяснить различием механизмов соосаждения - поглощение радия осадком BaSO4 обусловлено процессами сокристаллизации и вторичной адсорбции, а поглощение поливалентных ионов происходит, например, за счет механического включения их в кристаллы сульфата бария, которые при быстром осаждении образуются несовершенными по форме, что способствует окклюзии. Что касается полученных ранее [5] результатов, то эффект более полного соосаждения радия из предварительно нейтрализованных кальцийсодержащих растворов может быть объяснен влиянием величины рН. В частности, в работе [6] показано, что при солянокислотном разложении перовскита для достижения минимальных значений активности хлоридных кальцийсодержащих (до 300 г/дм3 CaCl2) растворов их обработку хлоридом бария и сульфатом натрия необходимо осуществлять при рН ≥ 7. При этом делается вывод, что в системах с высокой концентрацией хлорида кальция растворимость BaSO4 (и CaSO4, на котором частично соосаждается радий) минимальна при значениях рН ≥ 7.
Полученные данные свидетельствуют также том, что при соосаждении радия с сульфатом бария в присутствии макроколичеств Na+ достичь полной дезактивации раствора в одну стадию не удается. Для повышения степени соосаждения радия были проведены опыты, в основу которых положены прием соосаждения радия с сульфатом бария и последующее поглощение оставшегося радия оксигидратами железа или алюминия в условиях формирования осадка. Экспериментально установлено, что наличие в исходном радийсодержащем растворе ионов поливалентных металлов, в частности Fe3+ и Al3+ и последующая нейтрализация такого раствора щелочью, например, NaOH, способствуют повышению степени соосаждения за счет адсорбции части радия на осадке оксигидратов железа и алюминия. При этом повышение рН нейтрализации и нагревание пульпы способствуют более полному выделению радия за счет его поглощения оксигидратным осадком. При более высоком значении рН, равном 12, практически полная дезактивация (99,99%) достигается при меньшем количестве железа в растворе, чем при рН 8 (рис. 3). При нейтрализации радийсодержащего раствора в присутствии алюминия максимальное выделение радия в твердую фазу достигается при рН = 9,5, чему способствует образование оксигидрата алюминия, который совместно с BaSO4 поглощает радий.
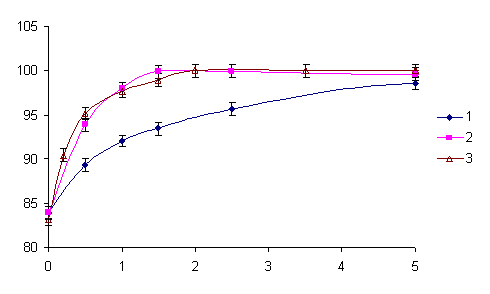
Рис. 3. Зависимость степени соосаждения радия с сульфатом бария от количества Fe (III) (1) и (2), или Al (3), введенного в исходный раствор: температура 85±2ºC, мольное отношение ; 1 - рН = 8,0±0,02; 2 - рН = 12,0±0,02; 3 - рН = 9,5±0,02.
Полученные данные были использованы нами при разработке*) новой, более эффективной по сравнению с ранее предложенной [3], технологии обезвреживания и дезактивации радиоактивных солевых растворов с исходной удельной активностью 100-200 кБк/кг, содержащих Th, Fe, Al, РЗЭ, Na, Mg, Ca и др. компоненты (рис. 4). В основу этой технологии положены предварительная нейтрализация раствором NaOH и последующая обработка фильтратов сначала растворами BaCl2, Na2SO4 и затем растворами FeCl3 и/или AlCl3 при рН 10-12. Опыты показали [9-10], что при переработке сложных по составу многокомпонентных солевых отходов процесса хлорирования лопаритового концентрата разработанная технология обеспечивает требуемую степень дезактивации: остаточная удельная активность менее 6 Бк/кг позволяет при этом сократить массу вторичных радиоактивных отходов, подлежащих захоронению в ХСО, в 1,5-2 раза.
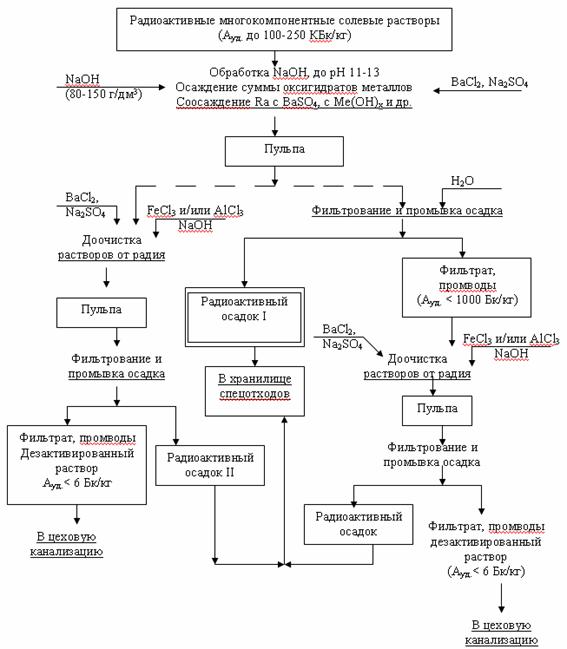
Рис. 4. Унифицированная технологическая схема дезактивации многокомпонентных солевых растворов
СПИСОК ЛИТЕРАТУРЫ:
- Крохин В.А., Солянов С.П., Мальцев Н.А.// Сб. Хлорная металлургия редких металлов. Науч. тр. Ин-та Гиредмет - М.: Металлургия, 1969. С. 153-159.
- Кудрявский Ю.П. // Современные наукоемкие технологии, 2005, № 6.
С. 12-16. - Белкин А.В., Кудрявский Ю.П. // Обезвреживание и переработка отходов титано-магниевого производства. Сб. науч. трудов. Запорожье. 1987. С. 37-42.
- Кудрявский Ю.П., Белкин А.В., Пахолков В.С. // Химия и технология неорганических сорбентов. Межвузовский сб. науч. Трудов. Пермь. 1989. С. 42-49.
- Кудрявский Ю.П., Рахимова О.В., Гращенко С.М. // Радиохимия, 2007, Вып 5. С. 477-480.
- А.В. Белкин, Ю.П. Кудрявский, С.А. Анферов // Радиохимия. 1988. № 2.
С. 281-285. - В.Г. Майоров, Х.Б. Авсарагов, В.К. Копков и др.//Журнал прикладной химии. 2005. Т. 78. Вып. 10. С. 1596-1600.
- Кудрявский Ю.П. Рахимова О.В., Зеленин В.И.// Сорбционные и хроматографические процессы. 2006. №6. Том 6. Часть 3. С. 1192-1197.
- Кудрявский Ю.П., Рахимова О.В., Черный С.А. // Экология и промышленность России. 2007. № 4. С. 43-45.
- Кудрявский Ю.П., Жуланов Н.К., Дернов А.Ю., Рахимова О.В., Черный С.А. // Цветные металлы. 2007. № 6. С.83-87.
*) В работе принимали участие А.В. Белкин, А.Г. Юков, Б.В. Каржавин, Ю.А. Ряпосов, Н.К. Жуланов, В.С. Белослудцев.
*) В работе принимали участие работники ОАО «СМЗ», сотрудники: Ю.А. Дернов, Н.К. Жуланов, В.Б. Каржавин, В.Н. Корюков, Н.М. Мартынов, Д.Л. Мельников, Ю.А. Ряпосов, С.А. Черный



