ВВЕДЕНИЕ
Первой работой, вышедшей после 1952 года (года создания ионной теории возбуждения Ходжкина-Хаксли) и посвящённой изучению действия тетраэтиламмония (ТЭА) на электрическую активность нервных волокон, стала статья В. Бурке с соавторами [8]. В немиелинизированных нервных волокнах краба, избранных авторами для исследования, ТЭА приводил к продлению потенциала действия (ПД), что связывалось авторами с уменьшением выхода ионов калия из аксона. В экспериментах на гигантских аксонах кальмара [19] показано, что внутриаксональное введение ТЭА вызывает значительное расширение нисходящей фазы ПД с образование длительного (10-30 мс) плато, в то время как применение ТЭА с наружной стороны мембраны не сказывается на параметрах ПД. В дальнейшем факт продления ПД под действием ТЭА был установлен и для миелинизированных нервных волокон амфибий [1, 6, 17, 18]. Как выяснилось, степень продления ПД под влиянием ТЭА зависит от того, является ли нервное волокно сенсорным или моторным. В сенсорных нервных волокнах ПД расширялся в 2 раза, а в моторных - более чем в 3 раза [18]. В отличие от гигантских аксонов кальмара, в миелинизированных нервных волокнах амфибий ТЭА подавляет калиевый ток как при наружном, так и при внутриаксональном применении [14].
Исключительно важным для понимания механизма действия ТЭА стало разделение калиевой проводимости нодальной мембраны миелинизированных нервных волокон амфибий на две составляющие, быструю и медленную [2, 10, 13], и установление факта, что блокаторы калиевых каналов 4-аминопиридин (4-АП) и ТЭА различаются по способности блокировать данные два вида калиевой проводимости [10]. ТЭА блокирует как быструю, так и медленную компоненты калиевой проводимости [10, 13], а 4-АП - только быструю [10]. С этого времени блокаторы калиевых каналов 4-АП и ТЭА стали использоваться как инструмент для разделения быстрой и медленной калиевой проводимости и установления их роли в генерации электрических ответов различных нервных мембран [11, 15]. Это позволило не только эффективно идентифицировать быстрые и медленные калиевые каналы, но также определять характер их распределения в различных (нодальных, пара- и интернодальных) участках мембраны в норме и при де- и ремиелинизации [9, 12, 16].
Проведённые нами эксперименты показали, что далеко не все эффекты ТЭА известны и интерпретированы с позиции наличия в миелинизированных нервных волокнах двух (быстрой и медленной) калиевых проводимостей. Целью настоящей работы явилось описание эффектов ТЭА на спайковую и следовую часть ПД миелинизированных нервных волокон амфибий. Результаты настоящей работы представлены ранее в виде краткого сообщения [5].
МЕТОДИКА
Эксперименты (всего 42) проводили на одиночных миелинизированных нервных волокнах озёрной лягушки Rana ridibunda Pallas. Препаровку нервного волокна проводили таким образом, что изолировали лишь интернодальную часть волокна, а перехват Ранвье, от которого в последующем отводили ПД, оставляли интактным в нервном стволе. Схема расположения нервного волокна в экспериментальной камере приведена ранее [3]. Раздражение нервного волокна производили одиночными (длительностью 0.1 мс) и ритмическими (частотой 10, 50, 100 и 300 Гц) прямоугольными стимулами. Используемый в экспериментах раствор Рингера имел следующий состав (в ммоль/л): NaCl - 111; KCl - 2.5; CaCl2 - 1.95; NaHCO3 - 1.2. Эксперименты проводили при температуре 17-22о С. Статистическая обработка экспериментальных данных осуществлялась с использованием критерия Стьюдента.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В ответ на приложение к нервному волокну одиночного деполяризующего стимула возникал ПД (рис. 1), амплитуда которого в среднем составила 74.79 ± 9.78 мВ. Спайковая часть ПД переходила в хорошо выраженную следовую деполяризацию (СД), амплитуда и длительность которой составили в среднем 2.18 ± 0.54 мВ и 176.47 ± 37 мс соответственно.
Добавление к раствору Рингера, омывающему исследуемый перехват Ранвье, ТЭА в концентрации 10 ммоль/л вызывает расширение ПД (рис. 1, А). Длительность ПД, измеренная на уровне 1/3 амплитуды спайка, на 7 минуте действия ТЭА увеличилась по сравнению с исходной в 1.5-1.7 раза. По мере выдерживания нервного волокна в растворе Рингера с ТЭА происходило дальнейшее увеличение длительности ПД (вплоть до 3-кратного увеличения по сравнению с нормой), что сопровождалось ростом амплитуды и длительности СД.
Появление повторной активности под влиянием ТЭА отмечалось в сравнительно небольшом (20%) количестве случаев. Увеличение концентрации блокатора с 10 до 20 ммоль/л вело к возрастанию вероятности появления повторных ответов. На рис. 1, Б представлена типичная осциллограмма ответа нервного волокна в случае возникновения под действием ТЭА повторной активности. При увеличении времени действия блокатора количество повторных ответов возрастает и наблюдается рост амплитуды и длительности СД.
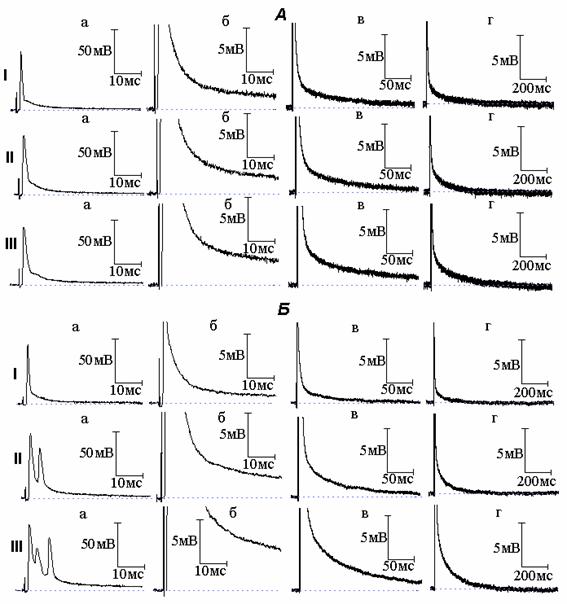
Рис. 1. Изменение электрической активности миелинизированных нервных волокон амфибий под влиянием тетраэтиламмония (ТЭА). А - вызванное ТЭА расширение потенциала действия (ПД): I - ПД (а) и следовая деполяризация (б - г) в нормальном растворе Рингера; II и III - то же через 6 (II) и 15 (III) минут действия ТЭА (10 момль/л). Б - возникновение под действием ТЭА повторной активности: I - ПД (а) и следовая деполяризация (б - г) в нормальном растворе Рингера; II и III - то же после 5 (II) и 10 (III) минут действия ТЭА
Вызванные ТЭА изменения длительности СД резко отличаются от изменений СД, наблюдаемых в опытах с другим блокатором калиевых каналов - 4-аминопиридином [4]. Если при блокировании 4-АП быстрых калиевых каналов длительность СД изменяется в три фазы (первоначальное увеличение, дальнейшее прекращение роста и, наконец, уменьшение длительности СД с переходом последней в следовую гиперполяризацию), то блокирование ТЭА быстрых и медленных калиевых каналов приводит лишь к однофазному изменению длительности СД - её постоянному росту по мере действия блокатора. Итак, изменения СД в присутствии 4-АП определяются различным вкладом быстрых и медленных калиевых каналов в реполяризацию мембраны: по мере всё большего блокирования 4-АП быстрых калиевых каналов и увеличения деполяризации мембраны (оцениваемой по росту площади ПД) их вклад в реполяризацию уменьшается, а активность медленных калиевых каналов увеличивается, что и приводит к характерному трёхфазному изменению длительности СД. В присутствии ТЭА такая ситуация не наблюдается вследствие блокирования обоих типов калиевых каналов, что и ведёт к однофазному изменению длительности СД. Необходимо отметить, что ТЭА, подавляя активность обоих типов калиевых каналов, более эффективно блокирует быстрые каналы [10, 11, 13]. Согласно данным J.M. Dubois [10], ТЭА в концентрации 3×10-4 моль уменьшает быстрый калиевый ток до 34.0 ± 2.2 % от исходного значения, а медленный - до 47.7 ± 3.3 % от исходного, то есть в этих условиях можно говорить о некотором преобладании медленного тока над быстрым (как видно, оно составляет всего 13.7 %). Это преобладание, разумеется, ни в какое сравнение не идёт с ситуацией блокирования калиевых каналов только 4-АП, когда быстрый калиевый ток блокируется почти полностью, а медленный калиевый ток вообще не затрагивается.
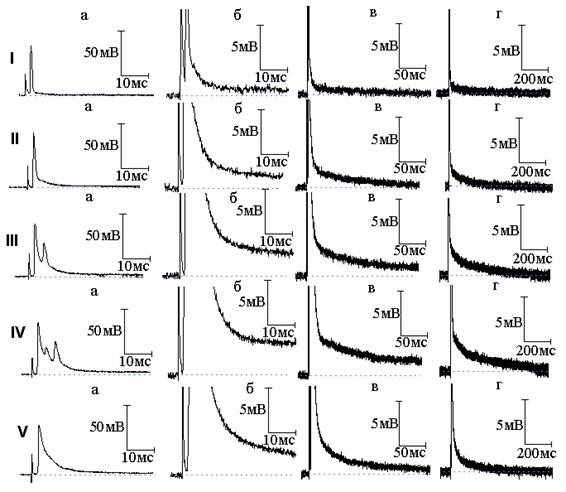
Рис. 2. Эффект совместного действия тетраэтиламмония (ТЭА) и новокаина: I - потенциал действия (а) и следовая деполяризация (б - г) в нормальном растворе Рингера; II, III, IV - то же после 7 (II), 10 (III) и 11 (IV) минут действия 10 ммоль/л ТЭА; V - то же после добавления к раствору Рингера, содержащему ТЭА, новокаина в концентрации 1×10-4 г/мл
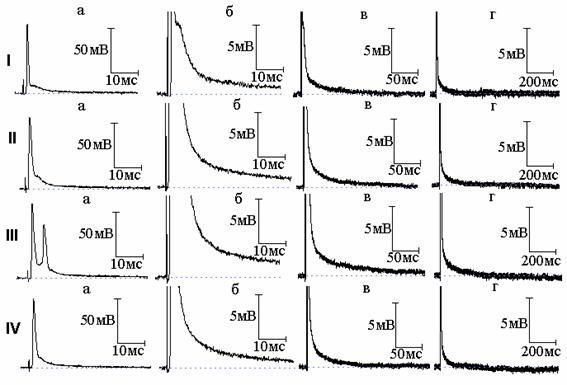
Рис. 3. Эффект совместного действия тетраэтиламмония (ТЭА) и тетродотоксина: I - потенциал действия (а) и следовая деполяризация (б - г) в нормальном растворе Рингера; II, III - то же после 8 (II) и 10 (III) минут действия 10 ммоль/л ТЭА; IV - то же после добавления к раствору Рингера, содержащему ТЭА, тетродотоксина в концентрации 1×10-6 ммоль/л
В нашей предыдущей работе [4] показано, что подавление натриевого тока новокаином приводит к уменьшению площади вызванного 4-АП многоспайкового ответа, но длительность СД после этого многоспайкового ответа увеличивается. Это явилось ещё одним подтверждением, что именно преобладание активности медленных калиевых каналов над быстрыми определяет временную динамику изменений СД в присутствии 4-АП. Возник вопрос, какие же изменения длительности СД будут наблюдаться в аналогичных условиях, но уже при действии ТЭА - когда не будет явного преобладания активности медленных каналов над быстрыми. Типичные осциллограммы данной серии экспериментов показаны на рис. 2 и 3. И в том, и в другом случае ТЭА привёл к возникновению многоспайковых ответов. После воздействия новокаина (рис. 2) и тетродотоксина (рис. 3) произошло уменьшение площади вызванного ТЭА многоспайкового ответа, что сопровождалось сокращением длительности СД. Полученный результат может быть объяснён следующим образом. Если при подавлении быстрого калиевого тока 4-АП продолжительность СД становится тем меньше, чем больше величина медленного калиевого тока (активирующегося тем сильнее, чем более растянут ПД, а значит более деполяризована мембрана), подавление натриевого тока, уменьшающего площадь ПД, а вследствие этого и величину медленного калиевого тока, приводит к увеличению длительности СД. В случае же действия ТЭА преобладание медленного калиевого тока не будет столь существенным (часть медленных каналов заблокирована), а раз так, уменьшение деполяризации мембраны в результате уменьшения площади ПД при подавлении натриевого тока уже не приведёт к заметному уменьшению величины медленного калиевого тока, и увеличения длительности СД не произойдёт. Таким образом, разница в изменениях длительности СД в присутствии 4-АП и ТЭА определяется различным соотношением быстрых и медленных калиевых токов во время реполяризации мембраны.
Ещё одним подтверждением этого стали эксперименты с ритмической стимуляцией нервных волокон при блокировании калиевых каналов. Как можно видеть на рис. 4, следовая деполяризация под действием ТЭА в начальной части ритмической стимуляции слегка возрастает от спайка к спайку. Совершенно иная картина наблюдается при блокировании быстрых калиевых каналов 4-АП [3]: наибольшая следовая деполяризация наблюдается вслед за первым спайком, после чего она начинает уменьшаться, пока не достигнет стационарного уровня (рис. 4). Различия в действии ТЭА и 4-АП на СД в начальной части ритмической стимуляции определяются разным относительным вкладом быстрых и медленных калиевых каналов в реполяризацию мембраны. В случае 4-АП блокирование быстрого калиевого тока приводит к увеличению общей деполяризации мембраны и активации медленного калиевого тока, который, всё более возрастая во время ритмической стимуляции (увеличения деполяризации мембраны), вызывает ускорение реполяризации мембраны, приводя к уменьшению СД в ритмическом ряду. В случае ТЭА, когда блокированы и быстрые, и медленные калиевые каналы, совершенно естественно не наблюдается столь сильного преобладания одного тока над другим, и поэтому СД в ритмическом ряду не уменьшается.
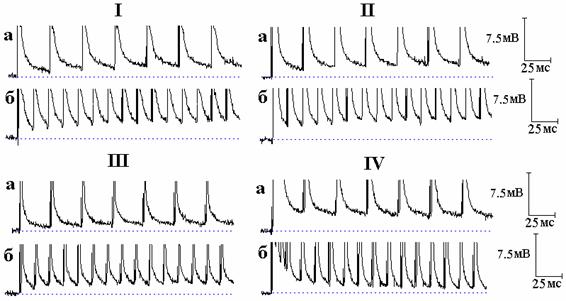
Рис. 4. Влияние тетраэтиламмония (ТЭА) и 4-аминопиридина (4-АП) на следовые потенциалы при ритмическом раздражении нервных волокон (показана начальная часть ритмической стимуляции). I - следовые потенциалы при ритмической стимуляции нервного волокна частотой 50 (а) и 100 Гц (б) в нормальном растворе Рингера. II - то же после 9 минут действия ТЭА. III - следовые потенциалы при ритмической стимуляции нервного волокна частотой 50 (а) и 100 Гц (б) в нормальном растворе Рингера. IV - то же после 12 минут действия 4-АП. Эксперименты с ТЭА и 4-АП проводились на разных волокнах.
Различный временной ход СД во время ритмической стимуляции в присутствии 4-АП и ТЭА ранее был показан на миелинизированных нервных волокнах крысы [7, рис. 11]: 4-АП приводил к снижению СД в ритмическом ряду, а последующее добавление ТЭА к раствору, содержащему 4-АП, вело к противоположному эффекту - увеличению СД от спайка к спайку. Авторы [7] указанную закономерность никаким образом не обсуждали. По всей видимости, обнаруженный данными авторами факт изменения хода увеличенной 4-АП следовой деполяризации под воздействием ТЭА также может быть объяснён тем, что наблюдаемое в присутствии 4-АП уменьшение величины СД в начальной части ритмической стимуляции определяется активированием медленного калиевого тока, который, будучи блокированным ТЭА, вызывает смену уменьшения СД в ритмическом ряду её увеличением. Важно заметить, что наблюдаемое авторами [7] под действием ТЭА увеличение СД в ритмическом ряду зарегистрировано в присутствии 4-АП, тогда как в наших экспериментах эффекты действия ТЭА и 4-АП изучались по отдельности, и увеличение СД под влиянием ТЭА наблюдалось в отсутствие 4-АП.
Представленные в работе экспериментальные данные дополняют сведения относительно разницы в действии ТЭА и 4-АП, подтверждая информацию о различном вкладе быстрых и медленных калиевых токов в развитие электрических процессов в мембране. Подтверждается информация, что активация медленных калиевых каналов происходит тем сильнее, чем больше была деполяризована мембрана.
ВЫВОДЫ
- Применение к миелинизированным нервным волокнам амфибий ТЭА в концентрации 10 и 20 ммоль/л вызывает расширение ПД, а также увеличение амплитуды и длительности СД. В 20 % случаев ТЭА приводит к возникновению многоспайковых ответов.
- Блокирование ТЭА быстрых и медленных калиевых каналов ведёт к однофазному изменению длительности СД - её постоянному росту по мере действия блокатора, что отличается от трёхфазного характера изменения длительности СД под влиянием блокатора быстрых калиевых каналов 4-АП.
- Подавление натриевого тока блокаторами натриевых каналов приводит к уменьшению площади вызванного ТЭА многоспайкового ответа и уменьшению длительности СД, что противоположно эффекту совместного действия блокаторов натриевых каналов и 4-АП: подавление натриевого тока приводит к уменьшению площади вызванного 4-АП многоспайкового ответа, но длительность СД при этом увеличивается.
- СД под влиянием ТЭА в начальной части ритмической стимуляции слегка возрастает от спайка к спайку, что отличается от эффекта блокатора быстрых калиевых каналов 4-АП, в присутствии которого СД в начальной части ритмической стимуляции от спайка к спайку уменьшается.
- Разница в изменениях длительности СД под действием ТЭА и 4-АП определяется различным вкладом быстрых и медленных калиевых токов в реполяризацию мембраны.
СПИСОК ЛИТЕРАТУРЫ:
- Беляев В.И. // Бюллетень экспериментальной биологии и медицины. - 1964. - № 12. С. 13.
- Ильин В.И., Катина И.Е., Лонский А.В., Маковский В.С., Полищук Е.В. // Биофизика мембран. - Материалы конференции 21-23 сентября 1973 г. - Каунас, 1973. - С. 286.
- Кузнецова И.В., Евстигнеев Д.А., Глухова Н.В. // Фiзiологiчний журнал (Киïв). - 2005. - Т. 51. - № 2. С. 96.
- Кузнецова И.В., Евстигнеев Д.А., Глухова Н.В. // Фiзiологiчний журнал (Киïв). - 2007. - Т. 53. - № 3. С. 61.
- Кузнецова И.В., Евстигнеев Д.А., Глухова Н.В. // Фундаментальные исследования. - 2007. - № 8. С. 56.
- Ходоров Б.И., Беляев В.И. // Биофизика клетки. - М., 1965. - С. 159.
- Baker M., Bostock H., Grafe P., Martius P. // J. Physiol. - 1987. - Vol. 383. P. 45.
- Burcke W., Katz B., Machne X. // J. Physiol. - 1953. - Vol. 122. P. 588.
- Chui S.Y., Ritchie J.M. // J. Physiol. - 1982. - Vol. 322. P. 485.
- Dubois J.M. // J. Physiol. - 1981. - Vol. 318. P. 279.
- Dubois J.M. // Aminopyridines and similarly acting drugs. - 1982. - New York: Pergamon press. - Р. 43.
- Grissmer S. // J. Physiol. - 1986. - Vol. 381. P. 119.
- Ilyin V.I., Katina I.E., Lonskii A.V., Makovsky V.S., Polishchuk E.V. // J. Membrane Biol. - 1980. - Vol. 57. P. 179.
- Koppenhöfer E. // Pflügers Archiv. - 1967. - Vol. 293. P. 34.
- Poulter M.P., Padjen A.L. // Neuroscience. - 1995. - Vol. 68. - № 2. P. 497.
- Rasband M.N., Trimmer J.S., Schwarz T.L., Levinson S.R., Ellisman M.N., Schachner M., Shrager P. // J. Neuroscience. - 1998. - Vol. 18. - № 1. P. 36.
- Schmidt H., Stämpfli R. // Pflügers Archiv. - 1964. - Vol. 279. P. R. 36.
- Schmidt H., Stämpfli R. // Pflügers Archiv. - 1966. - Vol. 287. P. 311.
- Tasaki I., Hagiwara S. // J. Gen. Physiol. - 1957. - Vol. 40. - № 6. P. 859.



