Таблица 1. Некоторые характеристики 3,3´-диамино-4,4´-дихлорариленов общей формулы:
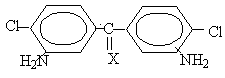
|
Х |
Т пл.,С0 |
Брутто - формула |
Элементный анализ |
Выход % |
|||
|
Вычислено /Найдено, % |
|||||||
|
С |
Н |
N |
С1 |
||||
|
=CCl2 |
416-418 |
С14H10N2CL4 |
48,31 49,12 |
2,89 2,68 |
8,05 8,05 |
40,70 41,41 |
53 |
|
=0 |
437-438 |
C13H10N2Ocl2 |
55,53 55,21 |
3,58 3,50 |
9,96 9,45 |
25,22 26,02 |
57 |
|
-CH2- |
369,5-371,5 |
C13H12N2CL2 |
58,44 58,63 |
4,52 4,61 |
10,48 10,63 |
26,54 25,77 |
63 |
Диамины такого типа было получено на основе ДДТ - продукта конденсации хлораля с хлорбензолом. В результате нитрования ДДТ был получен 1,1,1-трихлор-2,2-ди (З-нитро-4-хлорфенил) этан, дегидрохлорированием которого был получен 1,1-дихлор-2,2-ди (З-нитро-4-хлорфенил) этилен, восстановленный далее до 1,1-дихлор-2,2-ди (3-амино-4хлорфснил) этилена.
Строение промежуточных и конечного продуктов было подтверждено данными элементного (табл. 1) и ИК-спектрального анализов.
Так, в ИК-спектре 1,1,1-трихлор-2,2 - ди (4 - хлорфенил) этана содержатся максимумы поглощения в областях 750-657 см -1, характерные для связей С - CI алиф. Трихлорметильной группировки, а также в области 840 см -1, приписываемый связи Cар - CI. Нитрование этого соединения сопровождалось появлением в ИК - спектре максимумов поглощения, характерных для нитрогрупп, а также сдвигом максимумов поглощения, характерных для трихлорметильной и Cар - CI - группировок в области 785 и 885 см -1 соответственно. Дегидрохлорирование 1,1,1 - трихлор - 2,2 - ди ( 3-нитро - 4 - хлорфенил) этана сопровождалось исчезновением максимумов поглощения, характерных для трихлорметильных групп и появлением максимумов поглощения в областях 840 и 980 см -1, относящихся к 1,1 - дихлорэтиленовым группировкам в нитросодержащих продуктах. Восстановление 1.1- дихлор - 2,2 - ди (3 - нитро - 4 -хлорфенил) этилена в 1,1 - дихлор - 2,2 - ди (3 -амино-4-хлорфенил) этилен сопровождалось исчезновением максимумов поглощения, характерных для нитрогрупп и появлением максимумов поглощения в областях 3400, 3320 и 3230 см -1, а также 1615 см -1, характерных для валентных и деформационных колебаний N-H в первичных аминах.
Далее для синтеза 3,31 - диамино - 4,41 - дихлорбензофенона и 3,31 - диамино - 4,4´ - дихлордифенилметана был использован 1,1-дихлор -2,2-ди (4-хлорфснил) этилен.
Действием на 1,1 - дихлор -2,2 - ди (4-хлорфенил) этилен азотной кислоты при температуре 95-98 0С был получен 3,3´-динитро -4,41-дихлорбензофенон.
Условия каталитического восстановления 3,31-динитро -4,41-дихлорбензофенона и 3,31-диамино -4,41-дихлорбензофенона до 3,31 диамино -4,41 -дихлордифенилметана выбраны на основе анализа данных по восстановлению бензофенона в дифенилметан.
Более удачным оказался метод синтеза 3,31 диамино -4,41 -дихлордифенилметана с использованием реакции Кинжера-Вольфа по модификации Хуанг - Минлона, т.е. смесью гидразин-гидрата и гидроксида калия в диэтиленгликоле при 200 °С в течение 0,5 часа. Попытки каталитического восстановления 3,31 -динитро -4,41--..дихлорбензофенона и 3,31 диамино -4,41-дихлорбензофенона водородом над Ni/Ренея в жестких условиях не привели к успеху: возможно, это объясняется отравлением катализатора восстановления хлорсодержащими соединениями.
Строение полученных таким образом 3,31-диамино -4.41-дихлорбензофенона и 3,31-диамино -4.4 -дихлордифенилметана подтверждены данными элементного (табл.1) и ИК - спектрального анализов.



